Home / Training / Manuals / Colposcopia e tratamento da neoplasia intra-epitelial cervical: Manual para principiantes / Capítulo 2: Introdução à neoplasia intraepitelial cervical (NIC)
 Quadro 2.1: Correlação entre displ...
Quadro 2.1: Correlação entre displ...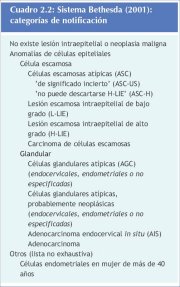 Quadro 2.2: Sistema de Bethesda de...
Quadro 2.2: Sistema de Bethesda de...
 figura 2.1: Aspecto citológico de ...
figura 2.1: Aspecto citológico de ...
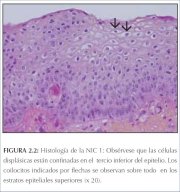 figura 2.2: Histologia da NIC 1: o...
figura 2.2: Histologia da NIC 1: o...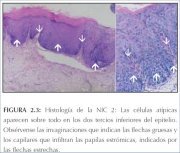 figura 2.3: Histologia da NIC 2: c...
figura 2.3: Histologia da NIC 2: c...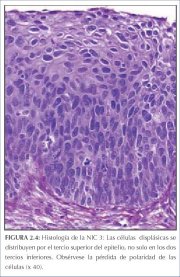 figura 2.4: Histologia da NIC 3: c...
figura 2.4: Histologia da NIC 3: c...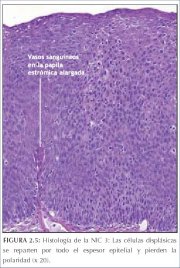 figura 2.5: Histologia da NIC 3: c...
figura 2.5: Histologia da NIC 3: c...
 quadro 2.3: Probabilidades de regr...
quadro 2.3: Probabilidades de regr... quadro 2.4: História natural da SI...
quadro 2.4: História natural da SI...
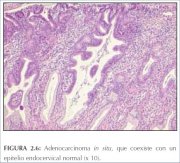 figure 2.6: Adenocarcinoma in situ...
figure 2.6: Adenocarcinoma in situ...
Colposcopia e tratamento da neoplasia intra-epitelial cervical: Manual para principiantes, J.W. Sellors & R. Sankaranarayanan
Capítulo 2: Introdução à neoplasia intraepitelial cervical (NIC)
Filter by language: English / Français / Español / Portugues / 中文- As neoplasias invasivas do colo uterino de células escamosas são precedidas por uma longa fase de doença pré-invasiva, conjuntamente denominada de neoplasia intraepitelial cervical (NIC).
- A NIC é categorizada em graus 1, 2 e 3, dependendo da proporção da espessura do epitélio que apresenta células maduras e diferenciadas.
- Os graus mais graves da NIC (2 e 3) apresentam uma maior proporção da espessura do epitélio composto de células indiferenciadas.
- A infecção persistente, provocada por um ou mais dos subtipos oncogênicos de papilomavírus humano (HPV), é uma causa necessária da neoplasia cervical.
- A maioria das anomalias cervicais causadas pela infecção do HPV tem pouca probabilidade de progredir a NIC ou neoplasia do colo uterino de alto grau.
- A maioria das NIC de baixo grau regride em períodos relativamente curtos ou não progridem a lesões de alto grau.
- A NIC de alto grau apresenta uma probabilidade muito maior de progredir a neoplasia invasiva.
- A lesão precursora que se origina do epitélio colunar é denominada de adenocarcinoma in situ (AIS). O AIS pode estar associado a NIC em um a dois terços dos casos.
Neoplasias invasivas do colo uterino são em geral precedidas por uma longa fase de doença pré-invasiva. Microscopicamente, isto se caracteriza como uma gama de eventos que progridem da atipia celular a graus variados de displasia ou neoplasia intraepitelial cervical (NIC) antes da progressão ao carcinoma invasivo. Um bom conhecimento da etiologia, fisiopatologia e história natural da NIC proporciona uma base sólida tanto para tanto para o exame visual como para o diagnóstico colposcópico e a compreensão dos princípios do tratamento dessas lesões. Este capítulo descreve a evolução dos sistemas de classificação das lesões precursoras da neoplasia cervical de células escamosas, a base histocitológica do seu diagnóstico, assim como sua história natural em termos de regressão, persistência e taxas de progressão. Também são descritas as lesões pré-neoplásicas que se originam no epitélio colunar cervical, comumente denominadas de lesões glandulares.
O conceito de lesões precursoras da neoplasia do colo uterino remonta ao fim do século XIX, quando áreas de alterações epiteliais atípicas não invasivas foram identificadas em amostras teciduais adjacentes às neoplasias invasivas (William, 1888). O termo carcinoma in situ (CIS) foi introduzido em 1932 para indicar as lesões em que as células carcinomatosas indiferenciadas ocupavam a espessura total do epitélio, sem ruptura da membrana basal (Broders, 1932). A associação entre o CIS e a neoplasia invasiva do colo uterino foi posteriormente verificada. O termo displasia foi introduzido no final dos anos 50 para designar a atipia epitelial cervical intermediária entre o epitélio normal e o CIS (Reagan et al., 1953). A displasia recebeu uma categorização adicional em três grupos – leve, moderada e grave – dependendo do grau de comprometimento da espessura epitelial por células atípicas. Posteriormente, durante muitos anos, as lesões pré-neoplásicas cervicais passaram a ser indicadas segundo as categorias de displasia e CIS, e ainda são amplamente usadas em muitos países em desenvolvimento.
Um sistema da classificação dividido em classes distintas para displasia e CIS se tornou cada vez mais arbitrário, baseado nos achados de vários estudos de seguimento com as mulheres portadoras de tais lesões. Observou-se que alguns casos de displasia regrediam, alguns persistiam e outros progrediam a CIS. Uma correlação direta com progressão e grau histológico foi verificada. Essas observações levaram ao conceito de um único processo patológico contínuo pelo qual o epitélio normal evolui a lesões precursoras epiteliais e a neoplasia invasiva. Com base nas observações anteriores, o termo neoplasia intraepitelial cervical (NIC) foi introduzido em 1968 para indicar uma ampla gama de atipia celular limitada ao epitélio. A NIC foi dividida em graus 1, 2 e 3 (Richart 1968). A NIC 1 correspondia à displasia leve, a NIC 2 à displasia moderada e a NIC 3 à displasia grave e CIS.
Nos anos 80, as alterações anatomopatológicas tais como a atipia coilocítica ou condilomatosa associada à infecção do papilomavírus humano (HPV) foram cada vez mais identificadas. Coilócitos são células atípicas com uma cavitação ou auréola perinuclear no citoplasma que indica alterações citopáticas devidas à infecção pelo HPV. Isto levou ao desenvolvimento de um sistema histológico simplificado de dois graus. Assim, em 1990, foi proposta uma terminologia histopatológica baseada em dois graus da doença: NIC de baixo grau que compreendia anomalias compatíveis com atipia coilocítica e lesões NIC 1 e NIC de alto grau que compreendia a NIC 2 e 3. As lesões de alto grau foram consideradas como genuínas precursoras da neoplasia invasiva (Richart 1990).
Em 1988, o Instituto Nacional do Câncer dos Estados Unidos realizou um simpósio para propor um novo esquema de registro dos resultados da citologia cervical (Relatório do Simpósio de NIC, 1989; Solomon, 1989; Kurman et al., 1991). As recomendações deste simpósio e a revisão posterior em um segundo simpósio realizados em 1991 ficaram conhecidas como Sistema Bethesda (TBS) (Relatório do Simpósio de NIC, 1992). A característica principal do TBS foi a criação do termo lesão intraepitelial escamosa (SIL) e um esquema de dois graus que compreendia lesões de baixo grau (LSIL) e alto grau (HSIL). A classificação de TBS combina alterações condilomatosas (HPV) planas e NIC de baixo grau (NIC 1) em LSIL, enquanto a HSIL compreende NIC mais avançada, como NIC 2 e 3. O termo lesão foi usado para enfatizar que qualquer uma das alterações morfológicas em que se baseia um diagnóstico não identifica necessariamente um processo neoplásico. Embora elaborado para a notificação citológica, o TBS é também usado para informar sobre achados histopatológicos. O TBS é predominantemente usado na América do Norte. A correlação entre a terminologia de displasia/in situ e os vários graus de NIC, assim como o TBS, são apresentados no quadro 2.1. A terminologia de NIC é usada neste manual ao se tratar dos graus variados de lesões pré-neoplásicas escamosas cervicais.
O TBS foi reavaliado e revisado em um simpósio em 2001 convocado pelo Instituto Nacional do Câncer, EUA, co-patrocinado por 44 sociedades profissionais representativas de mais de 20 países (Solomon et al., 2002). As categorias do Sistema Bethesda de 2001 são resumidas no quadro 2.2.
O conceito de lesões precursoras da neoplasia do colo uterino remonta ao fim do século XIX, quando áreas de alterações epiteliais atípicas não invasivas foram identificadas em amostras teciduais adjacentes às neoplasias invasivas (William, 1888). O termo carcinoma in situ (CIS) foi introduzido em 1932 para indicar as lesões em que as células carcinomatosas indiferenciadas ocupavam a espessura total do epitélio, sem ruptura da membrana basal (Broders, 1932). A associação entre o CIS e a neoplasia invasiva do colo uterino foi posteriormente verificada. O termo displasia foi introduzido no final dos anos 50 para designar a atipia epitelial cervical intermediária entre o epitélio normal e o CIS (Reagan et al., 1953). A displasia recebeu uma categorização adicional em três grupos – leve, moderada e grave – dependendo do grau de comprometimento da espessura epitelial por células atípicas. Posteriormente, durante muitos anos, as lesões pré-neoplásicas cervicais passaram a ser indicadas segundo as categorias de displasia e CIS, e ainda são amplamente usadas em muitos países em desenvolvimento.
Um sistema da classificação dividido em classes distintas para displasia e CIS se tornou cada vez mais arbitrário, baseado nos achados de vários estudos de seguimento com as mulheres portadoras de tais lesões. Observou-se que alguns casos de displasia regrediam, alguns persistiam e outros progrediam a CIS. Uma correlação direta com progressão e grau histológico foi verificada. Essas observações levaram ao conceito de um único processo patológico contínuo pelo qual o epitélio normal evolui a lesões precursoras epiteliais e a neoplasia invasiva. Com base nas observações anteriores, o termo neoplasia intraepitelial cervical (NIC) foi introduzido em 1968 para indicar uma ampla gama de atipia celular limitada ao epitélio. A NIC foi dividida em graus 1, 2 e 3 (Richart 1968). A NIC 1 correspondia à displasia leve, a NIC 2 à displasia moderada e a NIC 3 à displasia grave e CIS.
Nos anos 80, as alterações anatomopatológicas tais como a atipia coilocítica ou condilomatosa associada à infecção do papilomavírus humano (HPV) foram cada vez mais identificadas. Coilócitos são células atípicas com uma cavitação ou auréola perinuclear no citoplasma que indica alterações citopáticas devidas à infecção pelo HPV. Isto levou ao desenvolvimento de um sistema histológico simplificado de dois graus. Assim, em 1990, foi proposta uma terminologia histopatológica baseada em dois graus da doença: NIC de baixo grau que compreendia anomalias compatíveis com atipia coilocítica e lesões NIC 1 e NIC de alto grau que compreendia a NIC 2 e 3. As lesões de alto grau foram consideradas como genuínas precursoras da neoplasia invasiva (Richart 1990).
Em 1988, o Instituto Nacional do Câncer dos Estados Unidos realizou um simpósio para propor um novo esquema de registro dos resultados da citologia cervical (Relatório do Simpósio de NIC, 1989; Solomon, 1989; Kurman et al., 1991). As recomendações deste simpósio e a revisão posterior em um segundo simpósio realizados em 1991 ficaram conhecidas como Sistema Bethesda (TBS) (Relatório do Simpósio de NIC, 1992). A característica principal do TBS foi a criação do termo lesão intraepitelial escamosa (SIL) e um esquema de dois graus que compreendia lesões de baixo grau (LSIL) e alto grau (HSIL). A classificação de TBS combina alterações condilomatosas (HPV) planas e NIC de baixo grau (NIC 1) em LSIL, enquanto a HSIL compreende NIC mais avançada, como NIC 2 e 3. O termo lesão foi usado para enfatizar que qualquer uma das alterações morfológicas em que se baseia um diagnóstico não identifica necessariamente um processo neoplásico. Embora elaborado para a notificação citológica, o TBS é também usado para informar sobre achados histopatológicos. O TBS é predominantemente usado na América do Norte. A correlação entre a terminologia de displasia/in situ e os vários graus de NIC, assim como o TBS, são apresentados no quadro 2.1. A terminologia de NIC é usada neste manual ao se tratar dos graus variados de lesões pré-neoplásicas escamosas cervicais.
O TBS foi reavaliado e revisado em um simpósio em 2001 convocado pelo Instituto Nacional do Câncer, EUA, co-patrocinado por 44 sociedades profissionais representativas de mais de 20 países (Solomon et al., 2002). As categorias do Sistema Bethesda de 2001 são resumidas no quadro 2.2.
 Quadro 2.1: Correlação entre displ...
Quadro 2.1: Correlação entre displ... Quadro 2.2: Sistema de Bethesda de...
Quadro 2.2: Sistema de Bethesda de...Características clínicas da NIC
Não há sintomas específicos nem características clínicos que indicam a presença da NIC. Muitas dessas lesões, contudo, podem ficar brancas na aplicação de ácido acético a 3-5% e podem ser iodo-negativas com a aplicação de solução de Lugol, já que o epitélio da NIC contém pouco ou nenhum glicogênio.
Diagnóstico e classificação da NIC pela citologia
A NIC é identificada mediante o exame microscópico das células cervicais em um esfregaço citológico corado pela técnica de Papanicolaou. Em preparados citológicos, alterações de células individuais são avaliadas para o diagnóstico da NIC e sua classificação. Em contraste, o exame histológico de todo o tecido permite o exame de várias outras características.
A avaliação citológica da NIC, baseada em alterações nucleares e citoplasmáticas, é com freqüência bastante difícil (figura 2.1).
O aumento de volume nuclear com variação no tamanho e forma é uma característica regular de todas as células displásicas (figura 2.1). Uma coloração mais intensa (hipercromasia) é outra característica marcante. Distribuição irregular de cromatina com grumos está presente em células displásicas. Figuras de mitose e nucléolos visíveis são pouco comuns nos esfregaços citológicos. Núcleos anormais em células superficiais ou intermediárias indicam uma NIC de baixo grau, enquanto que a anomalia em núcleos de células basais e parabasais indica NIC de alto grau . A quantidade de citoplasma com relação ao tamanho do núcleo (razão núcleo-citoplasma) é uma das características mais importantes para avaliar o grau da NIC (figura 2.1). Proporções maiores estão associadas com graus mais graves de NIC. Em geral, um esfregaço cervical contém células com uma variedade de alterações; portanto, a notificação dos achados implica em desafios consideráveis e subjetividade. A experiência do citologista é extremamente importante na notificação final.
A avaliação citológica da NIC, baseada em alterações nucleares e citoplasmáticas, é com freqüência bastante difícil (figura 2.1).
O aumento de volume nuclear com variação no tamanho e forma é uma característica regular de todas as células displásicas (figura 2.1). Uma coloração mais intensa (hipercromasia) é outra característica marcante. Distribuição irregular de cromatina com grumos está presente em células displásicas. Figuras de mitose e nucléolos visíveis são pouco comuns nos esfregaços citológicos. Núcleos anormais em células superficiais ou intermediárias indicam uma NIC de baixo grau, enquanto que a anomalia em núcleos de células basais e parabasais indica NIC de alto grau . A quantidade de citoplasma com relação ao tamanho do núcleo (razão núcleo-citoplasma) é uma das características mais importantes para avaliar o grau da NIC (figura 2.1). Proporções maiores estão associadas com graus mais graves de NIC. Em geral, um esfregaço cervical contém células com uma variedade de alterações; portanto, a notificação dos achados implica em desafios consideráveis e subjetividade. A experiência do citologista é extremamente importante na notificação final.
 figura 2.1: Aspecto citológico de ...
figura 2.1: Aspecto citológico de ...Diagnóstico e classificação da NIC pela histopatologia
Pode-se suspeitar de NIC no exame citológico usando a técnica de Papanicolaou ou por meio do exame colposcópico. O diagnóstico final da NIC é estabelecido mediante o exame anatomopatológico de uma biopsia cervical com saca-bocados ou amostra por excisão. O parecer sobre a presença de NIC em uma amostra tecidual cervical e o seu grau depende das características histológicas relativas a diferenciação, maturação e estratificação das células e anomalias nucleares. A proporção da espessura das células do epitélio com células maduras e diferenciadas é usada na classificação da NIC. Graus mais graves de NIC têm maior probabilidade de apresentar uma maior proporção da espessura do epitélio composto de células indiferenciadas com apenas uma fina camada de células maduras e diferenciadas na superfície.
Anomalias nucleares, como núcleos aumentados, maior razão núcleo-citoplasma, maior intensidade de coloração nuclear (hipercromasia), polimorfismo nuclear e variação do tamanho nuclear (anisocariose) são avaliados para fazer o diagnóstico. Há, com freqüência, uma forte correlação entre a proporção do epitélio que apresenta maturação e o grau de anomalia nuclear. Figuras de mitose são vistas em células em divisão; elas são pouco freqüentes no epitélio normal e, quando presentes, são vistas somente na camada parabasal. À medida que aumenta a gravidade da NIC, o número de figuras de mitose também aumenta e estas são vistas nas camadas superficiais do epitélio. Quanto menor a diferenciação do epitélio, mais alto é o nível em que as figuras de mitose são vistas. Configurações anormais de figuras de mitose também são levadas em consideração para se chegar ao diagnóstico definitivo.
Na NIC 1, há boa maturação com anomalias nucleares mínimas e poucas figuras de mitose (figura 2.2). Células indiferenciadas ficam limitadas às camadas mais profundas (terço inferior) do epitélio. As figuras de mitose estão presentes, mas não são numerosos. Alterações citopáticas devidas à infecção pelo HPV são observadas na espessura total do epitélio.
A NIC 2 é caracterizada por alterações celulares displásicas, principalmente restritas à metade inferior ou os dois terços inferiores do epitélio, com anomalias nucleares mais acentuadas que na NIC 1 (figura 2.3). Figuras de mitose são vistas em toda a metade inferior do epitélio.
Na NIC 3, diferenciação e estratificação podem estar totalmente ausentes ou estarem presentes somente no quarto superficial do epitélio com numerosas figuras de mitose (figuras 2.4 e 2.5). Anomalias nucleares estendem-se em toda a espessura do epitélio. As muitas figuras de mitose têm formas anormais.
Uma interação próxima entre citologistas, histopatologistas e colposcopistas melhora a notificação nas três disciplinas. Isto, em particular, contribui para diferenciar graus mais leves de NIC de outras afecções que podem causar confusão.
Anomalias nucleares, como núcleos aumentados, maior razão núcleo-citoplasma, maior intensidade de coloração nuclear (hipercromasia), polimorfismo nuclear e variação do tamanho nuclear (anisocariose) são avaliados para fazer o diagnóstico. Há, com freqüência, uma forte correlação entre a proporção do epitélio que apresenta maturação e o grau de anomalia nuclear. Figuras de mitose são vistas em células em divisão; elas são pouco freqüentes no epitélio normal e, quando presentes, são vistas somente na camada parabasal. À medida que aumenta a gravidade da NIC, o número de figuras de mitose também aumenta e estas são vistas nas camadas superficiais do epitélio. Quanto menor a diferenciação do epitélio, mais alto é o nível em que as figuras de mitose são vistas. Configurações anormais de figuras de mitose também são levadas em consideração para se chegar ao diagnóstico definitivo.
Na NIC 1, há boa maturação com anomalias nucleares mínimas e poucas figuras de mitose (figura 2.2). Células indiferenciadas ficam limitadas às camadas mais profundas (terço inferior) do epitélio. As figuras de mitose estão presentes, mas não são numerosos. Alterações citopáticas devidas à infecção pelo HPV são observadas na espessura total do epitélio.
A NIC 2 é caracterizada por alterações celulares displásicas, principalmente restritas à metade inferior ou os dois terços inferiores do epitélio, com anomalias nucleares mais acentuadas que na NIC 1 (figura 2.3). Figuras de mitose são vistas em toda a metade inferior do epitélio.
Na NIC 3, diferenciação e estratificação podem estar totalmente ausentes ou estarem presentes somente no quarto superficial do epitélio com numerosas figuras de mitose (figuras 2.4 e 2.5). Anomalias nucleares estendem-se em toda a espessura do epitélio. As muitas figuras de mitose têm formas anormais.
Uma interação próxima entre citologistas, histopatologistas e colposcopistas melhora a notificação nas três disciplinas. Isto, em particular, contribui para diferenciar graus mais leves de NIC de outras afecções que podem causar confusão.
 figura 2.2: Histologia da NIC 1: o...
figura 2.2: Histologia da NIC 1: o... figura 2.3: Histologia da NIC 2: c...
figura 2.3: Histologia da NIC 2: c... figura 2.4: Histologia da NIC 3: c...
figura 2.4: Histologia da NIC 3: c... figura 2.5: Histologia da NIC 3: c...
figura 2.5: Histologia da NIC 3: c...Etiopatogênese da neoplasia cervical
Estudos epidemiológicos identificaram vários fatores de risco que contribuem ao desenvolvimento de lesões precursoras da neoplasia do colo uterino e a própria neoplasia do colo uterino. Estas incluem infecção por certos tipos oncogênicos de papilomavírus humano (HPV), relação sexual precoce, múltiplos parceiros sexuais, multiparidade, uso prolongado de anticoncepcionais orais, tabagismo, baixo nível socioeconômico, infecção por Chlamydia trachomatis, deficiência de micronutrientes e uma dieta deficiente em vegetais e frutas (IARC, 1995; Bosch et al., 1995; Schiffman et al., 1996; Walboomers et al., 1999; Franco et al., 1999; Ferenczy e Franco, 2002).
O HPV tipos 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 e 68 são significativamente associados com NIC e neoplasia invasiva (IARC, 1995; Walboomers et al., 1999). Considera-se uma infecção persistente por um ou mais dos tipos oncogênicos mencionados anteriormente uma causa necessária da neoplasia cervical (IARC, 1995). A análise de resultados combinados de um estudo de caso-controle multicêntrico realizado pelo Centro Internacional de Pesquisas sobre o Câncer (IARC, 1995) revelou riscos relativos (RR) que variavam de 17 na Colômbia a 156 nas Filipinas, com um RR combinado de 60 (intervalo de confiança de 95%: 49−73) para a neoplasia do colo uterino (Walboomers et al., 1999). A associação foi igualmente significativa para o carcinoma escamoso (RR: 62) e o adenocarcinoma do colo uterino (RR: 51). O DNA do HPV foi detectado em 99,7% das 1.000 amostras avaliáveis de biopsia de neoplasia do colo uterino obtidas em 22 países (Walboomers et al., 1999; Franco et al., 1999). O HPV 16 e 18 são os principais genótipos virais encontrados em neoplasias do colo uterino em todo o mundo.
Vários estudos de coorte (seguimento) revelaram uma associação significativa entre a infecção persistente pelo HPV oncogênico e alto risco de desenvolver NIC (Koutsky et al., 1992; Ho et al., 1995; Ho et al., 1998; Moscicki et al., 1998; Liaw et al., 1999; Wallin et al., 1999; Moscicki et al., 2001; Woodman et al., 2001; Schlecht et al., 2002).
A infecção pelo HPV é transmitida através do contato sexual e os fatores de risco estão intimamente relacionados com o comportamento sexual (por exemplo, número de parceiros sexuais, relação sexual em idade precoce). Na maioria das mulheres, as infecções pelo HPV são transitórias. A história natural da infecção pelo HPV tem sido bastante reavaliada. Embora a prevalência da infecção pelo HPV varie em diferentes regiões do mundo, atinge em geral um pico de cerca de 20-30% das mulheres entre 20 e 24 anos de idade, com uma diminuição posterior a aproximadamente 3% a 10% das mulheres de mais de 30 anos de idade (Herrero et al., 1997a; Herrero et al., 1997b; Sellors et al., 2000). Cerca de 80% das mulheres jovens que contraem o HPV têm infecções transitórias que se resolvem em 12 a 18 meses (Ho et al., 1998; Franco et al., 1999; Thomas et al., 2000; Liaw et al., 2001).
Acredita-se que a infecção pelo HPV comece nas células basais ou parabasais do epitélio metaplásico. Se a infecção persiste, pode ocorrer a integração do genoma viral ao genoma celular do hospedeiro. A diferenciação e a maturação normal do epitélio escamoso metaplásico imaturo em maduro são interrompidas como resultado da expressão de oncoproteínas E6/E7 e da perda do controle de crescimento normal. Isto pode levar ao desenvolvimento de epitélio displásico anormal. Se o processo neoplásico segue ininterrupto, com o tempo as lesões precoces de baixo grau podem ocupar a espessura total do epitélio. Posteriormente, a doença pode atravessar a membrana basal e converter-se em neoplasia invasiva, estendendo-se aos órgãos adjacentes. A invasão atinge o sangue e vasos linfáticos e a doença se dissemina aos gânglios linfáticos e órgãos à distância.
O HPV tipos 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 e 68 são significativamente associados com NIC e neoplasia invasiva (IARC, 1995; Walboomers et al., 1999). Considera-se uma infecção persistente por um ou mais dos tipos oncogênicos mencionados anteriormente uma causa necessária da neoplasia cervical (IARC, 1995). A análise de resultados combinados de um estudo de caso-controle multicêntrico realizado pelo Centro Internacional de Pesquisas sobre o Câncer (IARC, 1995) revelou riscos relativos (RR) que variavam de 17 na Colômbia a 156 nas Filipinas, com um RR combinado de 60 (intervalo de confiança de 95%: 49−73) para a neoplasia do colo uterino (Walboomers et al., 1999). A associação foi igualmente significativa para o carcinoma escamoso (RR: 62) e o adenocarcinoma do colo uterino (RR: 51). O DNA do HPV foi detectado em 99,7% das 1.000 amostras avaliáveis de biopsia de neoplasia do colo uterino obtidas em 22 países (Walboomers et al., 1999; Franco et al., 1999). O HPV 16 e 18 são os principais genótipos virais encontrados em neoplasias do colo uterino em todo o mundo.
Vários estudos de coorte (seguimento) revelaram uma associação significativa entre a infecção persistente pelo HPV oncogênico e alto risco de desenvolver NIC (Koutsky et al., 1992; Ho et al., 1995; Ho et al., 1998; Moscicki et al., 1998; Liaw et al., 1999; Wallin et al., 1999; Moscicki et al., 2001; Woodman et al., 2001; Schlecht et al., 2002).
A infecção pelo HPV é transmitida através do contato sexual e os fatores de risco estão intimamente relacionados com o comportamento sexual (por exemplo, número de parceiros sexuais, relação sexual em idade precoce). Na maioria das mulheres, as infecções pelo HPV são transitórias. A história natural da infecção pelo HPV tem sido bastante reavaliada. Embora a prevalência da infecção pelo HPV varie em diferentes regiões do mundo, atinge em geral um pico de cerca de 20-30% das mulheres entre 20 e 24 anos de idade, com uma diminuição posterior a aproximadamente 3% a 10% das mulheres de mais de 30 anos de idade (Herrero et al., 1997a; Herrero et al., 1997b; Sellors et al., 2000). Cerca de 80% das mulheres jovens que contraem o HPV têm infecções transitórias que se resolvem em 12 a 18 meses (Ho et al., 1998; Franco et al., 1999; Thomas et al., 2000; Liaw et al., 2001).
Acredita-se que a infecção pelo HPV comece nas células basais ou parabasais do epitélio metaplásico. Se a infecção persiste, pode ocorrer a integração do genoma viral ao genoma celular do hospedeiro. A diferenciação e a maturação normal do epitélio escamoso metaplásico imaturo em maduro são interrompidas como resultado da expressão de oncoproteínas E6/E7 e da perda do controle de crescimento normal. Isto pode levar ao desenvolvimento de epitélio displásico anormal. Se o processo neoplásico segue ininterrupto, com o tempo as lesões precoces de baixo grau podem ocupar a espessura total do epitélio. Posteriormente, a doença pode atravessar a membrana basal e converter-se em neoplasia invasiva, estendendo-se aos órgãos adjacentes. A invasão atinge o sangue e vasos linfáticos e a doença se dissemina aos gânglios linfáticos e órgãos à distância.
História natural das lesões precursoras da neoplasia do colo uterino
Apesar da exposição freqüente das mulheres ao HPV, o surgimento da neoplasia cervical é pouco comum. A maioria das anomalias cervicais causadas pela infecção do HPV tem pouca probabilidade de progredir a NIC ou neoplasia do colo uterino de alto grau, visto que a maioria regride espontaneamente. A longa duração entre a infecção inicial e a doença manifesta indica que vários cofatores (por exemplo, diferenças genéticas, efeitos hormonais, deficiências de micronutrientes, tabagismo ou inflamação crônica) podem ser necessários para a progressão da doença. A regressão espontânea da NIC também pode indicar que muitas mulheres não estão expostas a esses cofatores.
Vários estudos trataram da história natural da NIC, com ênfase na regressão, persistência e progressão da doença (McIndoe et al., 1984; Ostor et al., 1993; Mitchell et al., 1994; Melinkow et al., 1998; Holowaty et al., 1999). Eles revelaram que a maioria das lesões de baixo grau é transitória; a maioria delas regride ao normal em períodos relativamente curtos ou não progride a formas mais graves. A NIC de alto grau , por outro lado, tem uma probabilidade muito maior de progredir a neoplasia invasiva, embora uma porcentagem de tais lesões também regride ou persiste. Parece que o intervalo médio para a progressão de lesões precursoras cervicais à neoplasia invasiva é de uns 10 a 20 anos.
Alguns estudos tentaram resumir as taxas de regressão, persistência e progressão da NIC. Embora esses estudos tenham muitas limitações, eles oferecem um insight interessante sobre o comportamento biológico dessas lesões. Os resultados de uma análise combinada de estudos publicados entre 1950 e 1993 são exibidos no quadro 2.3 (Ostor et al., 1993). Em outra revisão, as probabilidades acumulativas para todos os graus de NIC seguidos tanto por citologia como histologia foram de 45% para regressão, 31% para persistência e 23% para progressão (Mitchell et al., 1994). As taxas de progressão a neoplasia invasiva para estudos que fizeram o seguimento de pacientes CIS por biopsia variaram de 29% a 36% (McIndoe et al., 1984). Uma metaanálise de 27.000 mulheres forneceu taxas ponderadas médias de progressão a HSIL e neoplasia invasiva aos 24 meses segundo a anomalia citológica de base, apresentada no quadro 2.4 (Melinkow et al., 1998). Holowaty et al. (1999) calcularam o RR de progressão e regressão aos 2 anos de seguimento para displasias moderadas e graves, com a displasia leve usada como categoria de referência de base. O RR para CIS foi de 8,1 para displasia moderada e 22,7 para displasia grave. Os RR correspondentes para a neoplasia invasiva foram de 4,5 e 20,7, respectivamente.
Vários estudos trataram da história natural da NIC, com ênfase na regressão, persistência e progressão da doença (McIndoe et al., 1984; Ostor et al., 1993; Mitchell et al., 1994; Melinkow et al., 1998; Holowaty et al., 1999). Eles revelaram que a maioria das lesões de baixo grau é transitória; a maioria delas regride ao normal em períodos relativamente curtos ou não progride a formas mais graves. A NIC de alto grau , por outro lado, tem uma probabilidade muito maior de progredir a neoplasia invasiva, embora uma porcentagem de tais lesões também regride ou persiste. Parece que o intervalo médio para a progressão de lesões precursoras cervicais à neoplasia invasiva é de uns 10 a 20 anos.
Alguns estudos tentaram resumir as taxas de regressão, persistência e progressão da NIC. Embora esses estudos tenham muitas limitações, eles oferecem um insight interessante sobre o comportamento biológico dessas lesões. Os resultados de uma análise combinada de estudos publicados entre 1950 e 1993 são exibidos no quadro 2.3 (Ostor et al., 1993). Em outra revisão, as probabilidades acumulativas para todos os graus de NIC seguidos tanto por citologia como histologia foram de 45% para regressão, 31% para persistência e 23% para progressão (Mitchell et al., 1994). As taxas de progressão a neoplasia invasiva para estudos que fizeram o seguimento de pacientes CIS por biopsia variaram de 29% a 36% (McIndoe et al., 1984). Uma metaanálise de 27.000 mulheres forneceu taxas ponderadas médias de progressão a HSIL e neoplasia invasiva aos 24 meses segundo a anomalia citológica de base, apresentada no quadro 2.4 (Melinkow et al., 1998). Holowaty et al. (1999) calcularam o RR de progressão e regressão aos 2 anos de seguimento para displasias moderadas e graves, com a displasia leve usada como categoria de referência de base. O RR para CIS foi de 8,1 para displasia moderada e 22,7 para displasia grave. Os RR correspondentes para a neoplasia invasiva foram de 4,5 e 20,7, respectivamente.
 quadro 2.3: Probabilidades de regr...
quadro 2.3: Probabilidades de regr... quadro 2.4: História natural da SI...
quadro 2.4: História natural da SI...Adenocarcinoma in situ
A lesão precursora que se reconhece como tendo sido originada do epitélio colunar é denominada de adenocarcinoma in situ (AIS). No AIS, o epitélio colunar normal é substituído por epitélio anormal que revela perda da polaridade, aumento do tamanho das células, aumento do tamanho do núcleo, hipercromasia nuclear, atividade mitótica, redução da expressão de mucina citoplasmática e estratificação ou empilhamento celular (figura 2.6). Podem também ser observadas glândulas com ramificação e brotos anormais com projeções papilares epiteliais intraluminais sem estroma no seu interior também são observadas. São subdivididas, com base nos tipos de células em tipos de células, em endocervical, endometrióide, intestinal e misto. A maioria dos AIS é encontrada na zona de transformação. O AIS pode estar associado a NIC do epitélio escamoso em um a dois terços dos casos.
 figure 2.6: Adenocarcinoma in situ...
figure 2.6: Adenocarcinoma in situ...


