Home / Training / Manuals / La colposcopia y el tratamiento de la neoplasia intraepitelial cervical: Manual para principiantes / Capítulo 12: Tratamiento de la neoplasia intraepitelial cervical mediante crioterapia
 Figura 12.1 : Criosondas, aplicado...
Figura 12.1 : Criosondas, aplicado... Figura 12.2 : Equipo de crioterapi...
Figura 12.2 : Equipo de crioterapi... Figura 12.3 : Partes del equipo de...
Figura 12.3 : Partes del equipo de... Figura 13.3 : Bandeja de instrumen...
Figura 13.3 : Bandeja de instrumen... Figura 4.9 : Espéculo vaginal cubi...
Figura 4.9 : Espéculo vaginal cubi...
 Figura 12.1 : Criosondas, aplicado...
Figura 12.1 : Criosondas, aplicado... Figura 12.2 : Equipo de crioterapi...
Figura 12.2 : Equipo de crioterapi... Figura 12.3 : Partes del equipo de...
Figura 12.3 : Partes del equipo de... Figura 12.4 : Unidad de crioterapi...
Figura 12.4 : Unidad de crioterapi...
 Cuadro 12.1 : Criterios de admisib...
Cuadro 12.1 : Criterios de admisib...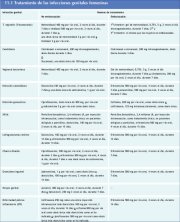 Cuadro 11.1 : Tratamiento de las i...
Cuadro 11.1 : Tratamiento de las i...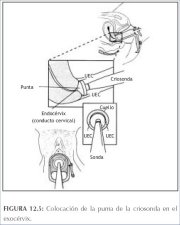 Figura 12.5 : Colocación de la pun...
Figura 12.5 : Colocación de la pun...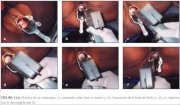 Figura 12.6 : Práctica de la criot...
Figura 12.6 : Práctica de la criot...
 Figura 12.5 : Colocación de la pun...
Figura 12.5 : Colocación de la pun... Figura 12.6 : Práctica de la criot...
Figura 12.6 : Práctica de la criot... Figura 12.1 : Criosondas, aplicado...
Figura 12.1 : Criosondas, aplicado... Figura 12.2 : Equipo de crioterapi...
Figura 12.2 : Equipo de crioterapi... Figura 12.3 : Partes del equipo de...
Figura 12.3 : Partes del equipo de... Figura 12.4 : Unidad de crioterapi...
Figura 12.4 : Unidad de crioterapi...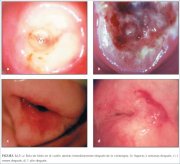 Figura 12.7 : a) Bola de hielo en ...
Figura 12.7 : a) Bola de hielo en ...
 Figura 12.7 : a) Bola de hielo en ...
Figura 12.7 : a) Bola de hielo en ...
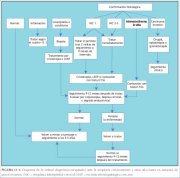 Cuadro 11.1 : Tratamiento de las i...
Cuadro 11.1 : Tratamiento de las i...
La colposcopia y el tratamiento de la neoplasia intraepitelial cervical: Manual para principiantes, J.W. Sellors & R. Sankaranarayanan
Capítulo 12: Tratamiento de la neoplasia intraepitelial cervical mediante crioterapia
Filter by language: English / Français / Español / Portugues / 中文- La crioterapia y la escisión electroquirúrgica por asa (LEEP) son opciones de tratamiento de la NIC apropiadas y eficaces tanto en entornos con muchos recursos como en los menos favorecidos, pues requieren menos inversión financiera en equipo y mantenimiento, y pueden aprenderse en un período corto.
- Comparado con el equipo necesario para LEEP, el de crioterapia cuesta mucho menos.
- La crioterapia requiere el suministro constante de gases comprimidos refrigerantes (N2O o CO2) en bombonas transportables. La crioterapia no es adecuada para tratar lesiones con afectación del endocérvix.
- Si se logra un contacto excelente entre la punta de la criosonda y el exocérvix, la crioterapia con N2O alcanzará -89°C y con CO2 -68°C en el núcleo de la bola de hielo y alrededor de -20°C en la periferia. Las células sometidas a -20°C durante más de un minuto llegan a la crionecrosis.
- La curación se produce en las seis semanas que siguen a la crioterapia. Estas pacientes pueden presentar exudado vaginal acuoso durante 3 ó 4 semanas después del tratamiento.
- Se les debe desaconsejar la ducha vaginal, los tampones y el coito durante un mes después del tratamiento.
- La crioterapia puede aumentar la transmisibilidad de la infección por VIH; los condones son un medio eficaz de prevención.
- El tratamiento fracasa en cerca del 5 al 10% de las mujeres.
La ablación y la escisión son dos formas de tratamiento
quirúrgico ambulatorio de las pacientes que presentan
neoplasia intraepitelial cervical (NIC). La crioterapia, la
electrocoagulación, la coagulación fría y la ablación por
láser son métodos de tratamiento exerético de la NIC.
La escisión electroquirúrgica por asa (LEEP), con finos
electrodos cerrados de alambre, y la escisión
electroquirúrgica cilíndrica con electrodos de aguja
larga son las formas principales de tratamiento ablativo
ambulatorio de las pacientes con NIC.
De todos los tratamientos disponibles y eficaces de la NIC, la crioterapia y la LEEP son apropiados tanto en entornos con muchos recursos como en los menos favorecidos por varias razones, por lo que son los únicos métodos presentados en este manual. En primer lugar, requieren menos inversión financiera en equipo, mantenimiento y reparación. En segundo lugar, una vez que se domina la colposcopia, la crioterapia y la LEEP pueden aprenderse rápidamente y dan lugar a altas tasas de curación y pocas complicaciones. Otras técnicas quirúrgicas a base de rayos láser o electrocoagulación exceden el alcance de este manual, por lo que se invita al lector a consultar los excelentes libros escritos al respecto (Wright et al., 1992; Wright et al., 1995; Singer y Monaghan, 2000).
La mayor preocupación al tratar la NIC mediante técnicas ablativas (destructoras) o exeréticas es saber si el tratamiento conseguirá erradicar toda NIC que haya invadido las criptas subyacentes al epitelio neoplásico. La posible profundidad de la afectación de la cripta aumenta con el grado de NIC. Para destruir una NIC 3 se necesita un tratamiento que sea eficaz a una profundidad de 7 mm. La longitud total de la lesión es un factor que también debe considerarse. Dicha longitud es la suma de dos distancias, cada una medida desde un punto de referencia del orificio cervical externo: la distancia al borde proximal (en dirección al conducto, o dentro de él) y la distancia al borde distal (el más alejado del conducto) de la lesión. La longitud promedio es 7,5 mm (entre 2 y 22 mm); entre 85% y 90% de las lesiones son enteramente visibles por fuera de la zona de transformación (Wright et al., 1995). Menos del 5% de las pacientes presentan implicación vaginal.
En este capítulo se presentan los principios y la práctica de la crioterapia, y en el próximo se describe la LEEP. El costo de compra y mantenimiento del equipo de crioterapia (Figuras 12.1, 12.2 y 12.3) es mucho menor que el de la LEEP. La crioterapia no requiere una fuente de electricidad, como la LEEP, sino bombonas fácilmente transportables de gas refrigerante muy comprimido. Una vez colocado el espéculo vaginal y visualizado el cuello uterino, ambos procedimientos toman aproximadamente 15 minutos.
La LEEP requiere equipo auxiliar pero la crioterapia no, por varias razones. La crioterapia no suele requerir un anestésico local, pero la LEEP sí precisa varias inyecciones de un anestésico local en el exocérvix. La LEEP genera humo que permanece en la vagina a menos que se aspire para seguir visualizando bien el campo operatorio. El tercer equipo auxiliar que requiere la LEEP es un espéculo vaginal con aislamiento eléctrico (y un retractor de las paredes laterales vaginales asimismo aislado, en caso necesario) (figura 13.3) o un espéculo metálico aislado con condón de látex (figura 4.9) para prevenir la lesión eléctrica (de choque o térmica) de la paciente o el operador si el asa o la bolita del electrodo lo toca accidentalmente. Un espéculo vaginal metálico conduce la electricidad, por lo que puede causar una lesión eléctrica a la vagina si el asa lo toca accidentalmente. Los espéculos y los retractores de paredes vaginales con aislamiento son más costosos que los que no lo llevan.
En contraposición a la LEEP, que es una técnica exerética, la crioterapia es ablativa. En términos prácticos, esto significa que tras la crioterapia no hay ninguna muestra histopatológica por evaluar, lo que obviamente presenta un ahorro inmediato de costos. Los partidarios de la LEEP prefieren disponer del informe anatomopatológico del tejido extirpado mediante el procedimiento de escisión electroquirúrgica por asa, que les permite no solo evaluar el grado más avanzado de lesión existente, sino también la adecuación de la escisión (si están o no involucrados los bordes de la escisión).
La limitación principal de la crioterapia es que no sirve para tratar las lesiones que no están totalmente ubicadas en el exocérvix, sino que afectan al conducto cervical. En cambio, la LEEP permite extirpar adecuadamente la mayoría de las lesiones cervicouterinas, independientemente de la afectación del conducto. El metanálisis de los estudios clínicos aleatorizados que evaluaron la eficacia comparativa de la crioterapia con otras terapias como la LEEP, la conización y el láser, llega a la conclusión de que estos tratamientos son igualmente eficaces para controlar la NIC (Nuovo et al., 2000; Martin-Hirch et al., 2000). De las comparaciones y los cotejos previos se desprende empíricamente con claridad que el método más práctico y económico de tratamiento de la NIC en entornos de bajos recursos es la crioterapia, a condición de que la lesión esté totalmente localizada en el exocérvix. La LEEP es el tratamiento preferido si la lesión afecta al conducto cervical (véase el capítulo 13).
Como la LEEP es una técnica más difícil que la crioterapia, se sugiere que los colposcopistas comiencen por dominar la crioterapia antes de pasar a la LEEP. Si un tejido vivo se congela a una temperatura de -20°C o inferior durante al menos 1 minuto, se produce crionecrosis. Varias son las características de este proceso: cristalización intracelular y extracelular, deshidratación, choque térmico, estasis vascular y desnaturalización de las proteínas. La congelación rápida seguida de descongelación lenta es de gran nocividad para las células, especialmente las neoplásicas. Una secuencia de dos ciclos de congelación y descongelación puede producir más destrucción tisular que un ciclo único.
En la crioterapia se emplea una criosonda con un extremo de metal muy conductor (generalmente plata y cobre), cuya superficie entra en contacto directo con la lesión exocervical. Se logra una gran disminución de la temperatura mediante la expansión, a través del pequeño orificio de la criosonda, del gas refrigerante comprimido. El óxido nitroso (N2O) o el dióxido de carbono (CO2) son los refrigerantes preferidos, pues ambos producen una transferencia térmica excelente al circular por la punta de la sonda.
De todos los tratamientos disponibles y eficaces de la NIC, la crioterapia y la LEEP son apropiados tanto en entornos con muchos recursos como en los menos favorecidos por varias razones, por lo que son los únicos métodos presentados en este manual. En primer lugar, requieren menos inversión financiera en equipo, mantenimiento y reparación. En segundo lugar, una vez que se domina la colposcopia, la crioterapia y la LEEP pueden aprenderse rápidamente y dan lugar a altas tasas de curación y pocas complicaciones. Otras técnicas quirúrgicas a base de rayos láser o electrocoagulación exceden el alcance de este manual, por lo que se invita al lector a consultar los excelentes libros escritos al respecto (Wright et al., 1992; Wright et al., 1995; Singer y Monaghan, 2000).
La mayor preocupación al tratar la NIC mediante técnicas ablativas (destructoras) o exeréticas es saber si el tratamiento conseguirá erradicar toda NIC que haya invadido las criptas subyacentes al epitelio neoplásico. La posible profundidad de la afectación de la cripta aumenta con el grado de NIC. Para destruir una NIC 3 se necesita un tratamiento que sea eficaz a una profundidad de 7 mm. La longitud total de la lesión es un factor que también debe considerarse. Dicha longitud es la suma de dos distancias, cada una medida desde un punto de referencia del orificio cervical externo: la distancia al borde proximal (en dirección al conducto, o dentro de él) y la distancia al borde distal (el más alejado del conducto) de la lesión. La longitud promedio es 7,5 mm (entre 2 y 22 mm); entre 85% y 90% de las lesiones son enteramente visibles por fuera de la zona de transformación (Wright et al., 1995). Menos del 5% de las pacientes presentan implicación vaginal.
En este capítulo se presentan los principios y la práctica de la crioterapia, y en el próximo se describe la LEEP. El costo de compra y mantenimiento del equipo de crioterapia (Figuras 12.1, 12.2 y 12.3) es mucho menor que el de la LEEP. La crioterapia no requiere una fuente de electricidad, como la LEEP, sino bombonas fácilmente transportables de gas refrigerante muy comprimido. Una vez colocado el espéculo vaginal y visualizado el cuello uterino, ambos procedimientos toman aproximadamente 15 minutos.
La LEEP requiere equipo auxiliar pero la crioterapia no, por varias razones. La crioterapia no suele requerir un anestésico local, pero la LEEP sí precisa varias inyecciones de un anestésico local en el exocérvix. La LEEP genera humo que permanece en la vagina a menos que se aspire para seguir visualizando bien el campo operatorio. El tercer equipo auxiliar que requiere la LEEP es un espéculo vaginal con aislamiento eléctrico (y un retractor de las paredes laterales vaginales asimismo aislado, en caso necesario) (figura 13.3) o un espéculo metálico aislado con condón de látex (figura 4.9) para prevenir la lesión eléctrica (de choque o térmica) de la paciente o el operador si el asa o la bolita del electrodo lo toca accidentalmente. Un espéculo vaginal metálico conduce la electricidad, por lo que puede causar una lesión eléctrica a la vagina si el asa lo toca accidentalmente. Los espéculos y los retractores de paredes vaginales con aislamiento son más costosos que los que no lo llevan.
En contraposición a la LEEP, que es una técnica exerética, la crioterapia es ablativa. En términos prácticos, esto significa que tras la crioterapia no hay ninguna muestra histopatológica por evaluar, lo que obviamente presenta un ahorro inmediato de costos. Los partidarios de la LEEP prefieren disponer del informe anatomopatológico del tejido extirpado mediante el procedimiento de escisión electroquirúrgica por asa, que les permite no solo evaluar el grado más avanzado de lesión existente, sino también la adecuación de la escisión (si están o no involucrados los bordes de la escisión).
La limitación principal de la crioterapia es que no sirve para tratar las lesiones que no están totalmente ubicadas en el exocérvix, sino que afectan al conducto cervical. En cambio, la LEEP permite extirpar adecuadamente la mayoría de las lesiones cervicouterinas, independientemente de la afectación del conducto. El metanálisis de los estudios clínicos aleatorizados que evaluaron la eficacia comparativa de la crioterapia con otras terapias como la LEEP, la conización y el láser, llega a la conclusión de que estos tratamientos son igualmente eficaces para controlar la NIC (Nuovo et al., 2000; Martin-Hirch et al., 2000). De las comparaciones y los cotejos previos se desprende empíricamente con claridad que el método más práctico y económico de tratamiento de la NIC en entornos de bajos recursos es la crioterapia, a condición de que la lesión esté totalmente localizada en el exocérvix. La LEEP es el tratamiento preferido si la lesión afecta al conducto cervical (véase el capítulo 13).
Como la LEEP es una técnica más difícil que la crioterapia, se sugiere que los colposcopistas comiencen por dominar la crioterapia antes de pasar a la LEEP. Si un tejido vivo se congela a una temperatura de -20°C o inferior durante al menos 1 minuto, se produce crionecrosis. Varias son las características de este proceso: cristalización intracelular y extracelular, deshidratación, choque térmico, estasis vascular y desnaturalización de las proteínas. La congelación rápida seguida de descongelación lenta es de gran nocividad para las células, especialmente las neoplásicas. Una secuencia de dos ciclos de congelación y descongelación puede producir más destrucción tisular que un ciclo único.
En la crioterapia se emplea una criosonda con un extremo de metal muy conductor (generalmente plata y cobre), cuya superficie entra en contacto directo con la lesión exocervical. Se logra una gran disminución de la temperatura mediante la expansión, a través del pequeño orificio de la criosonda, del gas refrigerante comprimido. El óxido nitroso (N2O) o el dióxido de carbono (CO2) son los refrigerantes preferidos, pues ambos producen una transferencia térmica excelente al circular por la punta de la sonda.
 Figura 12.1 : Criosondas, aplicado...
Figura 12.1 : Criosondas, aplicado... Figura 12.2 : Equipo de crioterapi...
Figura 12.2 : Equipo de crioterapi... Figura 12.3 : Partes del equipo de...
Figura 12.3 : Partes del equipo de... Figura 13.3 : Bandeja de instrumen...
Figura 13.3 : Bandeja de instrumen... Figura 4.9 : Espéculo vaginal cubi...
Figura 4.9 : Espéculo vaginal cubi...Equipo de crioterapia (figuras 12.1, 12.2, 12.3 a 12.4)
La unidad de crioterapia consta de una bombona de gas
comprimido (botella), un marco con un tornillo de
sujeción y una entrada de gas que conecta la bombona
al aplicador a través de un tubo flexible por el que pasa
el gas, un manómetro que indica la presión del gas de la
bombona, un silenciador de la salida, un aplicador con
manecilla, un gatillo con el que se deja pasar el gas a
alta presión hacia la criosonda y la propia criosonda.
Casi todos los equipos tienen un manómetro con tres
zonas de color: amarilla, verde y roja. Al abrir la botella
de gas, si la aguja del manómetro se sitúa en la zona
verde, la presión de gas es adecuada para el
tratamiento; si se halla en la zona amarilla, la presión
es demasiado baja, por lo que hay que cambiar la
bombona antes de iniciar el tratamiento; si alcanza la
zona roja, la presión es excesiva y debe liberarse.
Consulte detenidamente el manual de instrucciones del
fabricante.
 Figura 12.1 : Criosondas, aplicado...
Figura 12.1 : Criosondas, aplicado... Figura 12.2 : Equipo de crioterapi...
Figura 12.2 : Equipo de crioterapi... Figura 12.3 : Partes del equipo de...
Figura 12.3 : Partes del equipo de... Figura 12.4 : Unidad de crioterapi...
Figura 12.4 : Unidad de crioterapi...Crioterapia para lesiones del exocérvix
En el cuadro 12.1 se presentan los criterios de
admisibilidad para crioterapia. Si la mujer presenta
cervicitis, tricomoniasis o vaginosis bacteriana, se le
puede ofrecer crioterapia de inmediato, con
tratamiento antimicrobiano simultáneo, o bien
tratamiento antimicrobiano y que regrese a las 2 ó 3
semanas para crioterapia (véase el capítulo 11, cuadro
11.1). Si presenta enfermedad pélvica inflamatoria
(EPI), es aconsejable retardar la crioterapia hasta haber
tratado y resuelto la infección. Si una mujer mayor
presenta atrofia pronunciada por deficiencia de
estrógeno y tinción indiferenciada del margen exterior
de una lesión, puede efectuarse una crioterapia tras un
tratamiento tópico con estrógenos y nueva valoración
colposcópica. La mujer debe dar el consentimiento
escrito para recibir el tratamiento, después de que se le
haya informado detalladamente sobre cómo se realizará
y las probabilidades de su eficacia, los efectos adversos,
las complicaciones, las secuelas a largo plazo y las
posibles alternativas para abordar su problema.
De cara a la eficacia del procedimiento, es aconsejable usar la mayor botella de gas refrigerante posible, de modo que haya gas suficiente para completar el tratamiento y se mantenga elevada la presión de salida del refrigerante por la punta de la sonda. Las bombonas ordinarias solo mantienen la presión adecuada para efectuar tres tratamientos. Una bombona grande tiene la ventaja de que permite tratar a más mujeres, pero su transporte de un consultorio a otro puede ser un problema.
Si se logra un contacto excelente entre la punta de la criosonda y el exocérvix (figuras 12.5 y 12.6b), la crioterapia con N2O alcanzará -89°C y con CO2 -68°C en el núcleo de la bola de hielo y alrededor de -20°C en la periferia. Las células sometidas a -20°C durante más de 1 minuto llegan a la crionecrosis. La temperatura mínima en la punta de la sonda debe ser de -60°C para una congelación eficaz. Durante todo el procedimiento, es fundamental establecer y mantener buen contacto entre la punta de sonda y el tejido: un mal contacto supone variaciones relativamente grandes de temperatura en la bola de hielo, que se plasman en distintos grados de eficacia en diversas partes del tejido tratado.
De cara a la eficacia del procedimiento, es aconsejable usar la mayor botella de gas refrigerante posible, de modo que haya gas suficiente para completar el tratamiento y se mantenga elevada la presión de salida del refrigerante por la punta de la sonda. Las bombonas ordinarias solo mantienen la presión adecuada para efectuar tres tratamientos. Una bombona grande tiene la ventaja de que permite tratar a más mujeres, pero su transporte de un consultorio a otro puede ser un problema.
Si se logra un contacto excelente entre la punta de la criosonda y el exocérvix (figuras 12.5 y 12.6b), la crioterapia con N2O alcanzará -89°C y con CO2 -68°C en el núcleo de la bola de hielo y alrededor de -20°C en la periferia. Las células sometidas a -20°C durante más de 1 minuto llegan a la crionecrosis. La temperatura mínima en la punta de la sonda debe ser de -60°C para una congelación eficaz. Durante todo el procedimiento, es fundamental establecer y mantener buen contacto entre la punta de sonda y el tejido: un mal contacto supone variaciones relativamente grandes de temperatura en la bola de hielo, que se plasman en distintos grados de eficacia en diversas partes del tejido tratado.
 Cuadro 12.1 : Criterios de admisib...
Cuadro 12.1 : Criterios de admisib... Cuadro 11.1 : Tratamiento de las i...
Cuadro 11.1 : Tratamiento de las i... Figura 12.5 : Colocación de la pun...
Figura 12.5 : Colocación de la pun... Figura 12.6 : Práctica de la criot...
Figura 12.6 : Práctica de la criot...La crioterapia, paso a paso (figuras 12.5 y 12.6)
La paciente debe cumplir los criterios de admisibilidad
expuestos en el cuadro 12.1. En general, es preferible
que el diagnóstico de NIC esté firmemente establecido
antes de proceder a la crioterapia. Sin embargo, puede
haber excepciones a esta regla general. Por ejemplo, en
los países en desarrollo, puede ofrecerse tratamiento a
las mujeres en su primera visita de colposcopia para
maximizar la cobertura (si no, las que no se presentan a
seguimiento no recibirían tratamiento de sus lesiones),
sobre la base de un diagnóstico colposcópico. Sin
embargo, puede llevarse a cabo una biopsia dirigida
antes de la crioterapia, para tener un diagnóstico
histológico de la lesión que se tratará después. Debe
explicarse a la paciente las posibilidades de
sobretratamiento o de tratamiento innecesario, sus
efectos colaterales y complicaciones, y obtenerse su
consentimiento informado.
El médico debe estar familiarizado con el equipo de crioterapia y los componentes (figuras 12.1-12.4) que se usarán en un entorno dado. Hay que leer detalladamente las instrucciones de uso y de seguridad del fabricante. Las normas de seguridad se seguirán escrupulosamente. Antes de iniciar la crioterapia, se comprobará la presión de gas, para asegurar que sea suficiente para el suministro eficaz de refrigerante por la punta de la sonda mientras dura el tratamiento. Deben respetarse las instrucciones del fabricante al respecto. En casi todos los equipos, la zona verde del manómetro corresponde a la presión adecuada (40-70 kg/cm2) y la zona amarilla a una presión baja (<40 kg/cm2). Si la presión de gas en la bombona es adecuada, la aguja se sitúa en la zona verde al abrir la espita para liberar el gas. Si la presión es baja, la congelación no será suficiente para alcanzar el grado necesario de crionecrosis. La presión de trabajo mínima tiene que ser 40 kg/cm2, sin lo cual la congelación será inadecuada. Si la presión es menor, se debe cambiar la bombona antes de proseguir el tratamiento.
Si la mujer vuelve a la consulta (tras confirmación histológica) para una segunda visita de tratamiento, hay que proceder a una evaluación colposcópica inmediatamente antes de la crioterapia para confirmar que la ubicación y la longitud de la lesión permiten una crioterapia eficaz.
El médico o la enfermera debe explicarle el tratamiento a la paciente y tranquilizarla, para ayudarle a relajarse durante la intervención. Después de que haya orinado, se la colocará en una posición de litotomía modificada y se expondrá el cuello uterino con el espéculo más grande que pueda introducirse cómodamente. Las secreciones se extraen con una torunda de algodón empapada en solución salina. Se aplica luego el ácido acético al 5% y se explora el cuello uterino con el colposcopio. Después se aplica la solución de Lugol para delinear los límites de la lesión. La crioterapia no requiere anestesia local.
La superficie de la criosonda se limpia con solución salina para obtener el contacto térmico adecuado con el cuello uterino y la disminución óptima de la temperatura tisular. Se aplica firmemente la punta de la criosonda, con su centro en el orificio externo. Es imprescindible velar por que las paredes vaginales no estén en contacto con la punta de la criosonda. Luego se pone en marcha el cronómetro y se aprieta el gatillo del aplicador para enfriar la criosonda en contacto con el cuello uterino. El gas sale con un siseo. Se tiene que visualizar la formación de hielo en la punta de la criosonda y en el cuello uterino a medida que avanza la congelación. Asegúrese de que la sonda cubra adecuadamente la lesión y la punta no toque ni congele parte alguna de la vagina durante la intervención.
La crioterapia debe constar de dos ciclos secuenciales de congelación-descongelación, cada uno de ellos con 3 minutos de congelación seguidos de 5 minutos de descongelación. Se controlará el tiempo de tratamiento con un cronómetro. La congelación adecuada se alcanza cuando la periferia de la bola de hielo sobrepasa 4 ó 5 mm del borde exterior de la punta de la sonda. Con ello se asegura la crionecrosis hasta una profundidad mínima de 5 mm. Para lograr homogéneamente este efecto en todo el campo de tratamiento, es sumamente importante establecer y mantener un contacto excelente entre la punta de la sonda y la superficie del exocérvix. Tras haber finalizado la segunda congelación de 3 minutos, espere el tiempo adecuado de descongelación antes de retirar la sonda del cuello uterino. Al terminar la descongelación, el hielo de la punta de la criosonda desaparece por completo y la sonda se retira haciéndola rotar suavemente en el cuello uterino. No intente quitar la punta de la sonda del cuello uterino antes de que la descongelación sea completa. Después de quitar la sonda, observe si el cuello uterino sangra. La figura 12.7a presenta la apariencia del cuello uterino inmediatamente después de la crioterapia.
Observe la bola de hielo formada en el cuello uterino. No introduzca gasa ni algodón en la vagina después de la intervención, para que puedan salir las secreciones. La paciente puede usar compresas higiénicas para que las secreciones no le manchen la ropa.
Después del uso, hay que pasar por la punta de la sonda un algodón impregnado en alcohol etílico o isopropílico de 60-90%, luego corresponde limpiarla bien con agua hervida, desinfectarla con glutaraldehído al 2% (véase el capítulo 14) y guardarla seca. Al acabar la intervención hay que descontaminar el aplicador, los tubos, el manómetro y la bombona, pasándoles un algodón impregnado en alcohol etílico o isopropílico de 60-90%.
El médico debe estar familiarizado con el equipo de crioterapia y los componentes (figuras 12.1-12.4) que se usarán en un entorno dado. Hay que leer detalladamente las instrucciones de uso y de seguridad del fabricante. Las normas de seguridad se seguirán escrupulosamente. Antes de iniciar la crioterapia, se comprobará la presión de gas, para asegurar que sea suficiente para el suministro eficaz de refrigerante por la punta de la sonda mientras dura el tratamiento. Deben respetarse las instrucciones del fabricante al respecto. En casi todos los equipos, la zona verde del manómetro corresponde a la presión adecuada (40-70 kg/cm2) y la zona amarilla a una presión baja (<40 kg/cm2). Si la presión de gas en la bombona es adecuada, la aguja se sitúa en la zona verde al abrir la espita para liberar el gas. Si la presión es baja, la congelación no será suficiente para alcanzar el grado necesario de crionecrosis. La presión de trabajo mínima tiene que ser 40 kg/cm2, sin lo cual la congelación será inadecuada. Si la presión es menor, se debe cambiar la bombona antes de proseguir el tratamiento.
Si la mujer vuelve a la consulta (tras confirmación histológica) para una segunda visita de tratamiento, hay que proceder a una evaluación colposcópica inmediatamente antes de la crioterapia para confirmar que la ubicación y la longitud de la lesión permiten una crioterapia eficaz.
El médico o la enfermera debe explicarle el tratamiento a la paciente y tranquilizarla, para ayudarle a relajarse durante la intervención. Después de que haya orinado, se la colocará en una posición de litotomía modificada y se expondrá el cuello uterino con el espéculo más grande que pueda introducirse cómodamente. Las secreciones se extraen con una torunda de algodón empapada en solución salina. Se aplica luego el ácido acético al 5% y se explora el cuello uterino con el colposcopio. Después se aplica la solución de Lugol para delinear los límites de la lesión. La crioterapia no requiere anestesia local.
La superficie de la criosonda se limpia con solución salina para obtener el contacto térmico adecuado con el cuello uterino y la disminución óptima de la temperatura tisular. Se aplica firmemente la punta de la criosonda, con su centro en el orificio externo. Es imprescindible velar por que las paredes vaginales no estén en contacto con la punta de la criosonda. Luego se pone en marcha el cronómetro y se aprieta el gatillo del aplicador para enfriar la criosonda en contacto con el cuello uterino. El gas sale con un siseo. Se tiene que visualizar la formación de hielo en la punta de la criosonda y en el cuello uterino a medida que avanza la congelación. Asegúrese de que la sonda cubra adecuadamente la lesión y la punta no toque ni congele parte alguna de la vagina durante la intervención.
La crioterapia debe constar de dos ciclos secuenciales de congelación-descongelación, cada uno de ellos con 3 minutos de congelación seguidos de 5 minutos de descongelación. Se controlará el tiempo de tratamiento con un cronómetro. La congelación adecuada se alcanza cuando la periferia de la bola de hielo sobrepasa 4 ó 5 mm del borde exterior de la punta de la sonda. Con ello se asegura la crionecrosis hasta una profundidad mínima de 5 mm. Para lograr homogéneamente este efecto en todo el campo de tratamiento, es sumamente importante establecer y mantener un contacto excelente entre la punta de la sonda y la superficie del exocérvix. Tras haber finalizado la segunda congelación de 3 minutos, espere el tiempo adecuado de descongelación antes de retirar la sonda del cuello uterino. Al terminar la descongelación, el hielo de la punta de la criosonda desaparece por completo y la sonda se retira haciéndola rotar suavemente en el cuello uterino. No intente quitar la punta de la sonda del cuello uterino antes de que la descongelación sea completa. Después de quitar la sonda, observe si el cuello uterino sangra. La figura 12.7a presenta la apariencia del cuello uterino inmediatamente después de la crioterapia.
Observe la bola de hielo formada en el cuello uterino. No introduzca gasa ni algodón en la vagina después de la intervención, para que puedan salir las secreciones. La paciente puede usar compresas higiénicas para que las secreciones no le manchen la ropa.
Después del uso, hay que pasar por la punta de la sonda un algodón impregnado en alcohol etílico o isopropílico de 60-90%, luego corresponde limpiarla bien con agua hervida, desinfectarla con glutaraldehído al 2% (véase el capítulo 14) y guardarla seca. Al acabar la intervención hay que descontaminar el aplicador, los tubos, el manómetro y la bombona, pasándoles un algodón impregnado en alcohol etílico o isopropílico de 60-90%.
 Figura 12.5 : Colocación de la pun...
Figura 12.5 : Colocación de la pun... Figura 12.6 : Práctica de la criot...
Figura 12.6 : Práctica de la criot... Figura 12.1 : Criosondas, aplicado...
Figura 12.1 : Criosondas, aplicado... Figura 12.2 : Equipo de crioterapi...
Figura 12.2 : Equipo de crioterapi... Figura 12.3 : Partes del equipo de...
Figura 12.3 : Partes del equipo de... Figura 12.4 : Unidad de crioterapi...
Figura 12.4 : Unidad de crioterapi... Figura 12.7 : a) Bola de hielo en ...
Figura 12.7 : a) Bola de hielo en ...El seguimiento de la crioterapia
Hay que explicarles a las mujeres cómo deben cuidarse
y qué síntomas pueden tener después del tratamiento:
pueden presentar cólicos ("calambres") leves y exudado
vaginal acuoso o ligeramente sanguinolento entre 4 y 6
semanas después del tratamiento. Se les debe
desaconsejar la ducha vaginal, los tampones y el coito
durante un mes después del tratamiento. Deben
comunicar la aparición de los siguientes síntomas en las
6 semanas que siguen al tratamiento: fiebre durante
más de 2 días, dolor hipogástrico intenso, exudado
vaginal purulento maloliente, sangrado con coágulos o
hemorragia persistente más de 2 días. Es preferible dar
por escrito las instrucciones sobre estos aspectos y
sobre el seguimiento.
La curación se produce en las seis semanas que siguen a la crioterapia. Durante las 2 ó 3 primeras semanas tras la crioterapia, la herida está cubierta por tejido de granulación (figura 12.7b), tras lo cual la superficie se reepiteliza. Normalmente, la herida sana por completo entre las 6 y 8 semanas posteriores al tratamiento. En las figuras 12.7c y 12.7d se muestra el aspecto del cuello uterino a los 3 y a los 12 meses de la crioterapia.
Se desconoce el efecto de la crioterapia sobre la posible transmisibilidad, desde las mujeres o hacia ellas, de la infección por el virus de la inmunodeficiencia humana (VIH) durante la fase de curación. Ha podido ponerse de manifiesto la eliminación de VIH-1 en las secreciones vaginales de seropositivas tratadas por NIC (Wright et al., 2001). Por consiguiente, los autores sugieren que se comunique a todas las mujeres que la crioterapia puede aumentar la transmisibilidad del VIH y que los condones son un medio eficaz de prevención. Conviene usarlos como mínimo durante 4 semanas, pero mejor durante 6. Lo ideal sería disponer de condones gratuitos en los consultorios de colposcopia en los entornos donde la infección por VIH es endémica.
Se debe programar una visita de seguimiento entre 9 y 12 meses después del tratamiento. Para el seguimiento, se harán citología o IVA, seguidas de colposcopia y biopsia dirigida según lo observado en la colposcopia, para evaluar la remisión o la persistencia de las lesiones. Si persisten, se repetirá el tratamiento. A las mujeres sin neoplasia se las puede orientar a un programa de tamizaje (si existe) o a seguimiento después de 3 ó 5 años.
La curación se produce en las seis semanas que siguen a la crioterapia. Durante las 2 ó 3 primeras semanas tras la crioterapia, la herida está cubierta por tejido de granulación (figura 12.7b), tras lo cual la superficie se reepiteliza. Normalmente, la herida sana por completo entre las 6 y 8 semanas posteriores al tratamiento. En las figuras 12.7c y 12.7d se muestra el aspecto del cuello uterino a los 3 y a los 12 meses de la crioterapia.
Se desconoce el efecto de la crioterapia sobre la posible transmisibilidad, desde las mujeres o hacia ellas, de la infección por el virus de la inmunodeficiencia humana (VIH) durante la fase de curación. Ha podido ponerse de manifiesto la eliminación de VIH-1 en las secreciones vaginales de seropositivas tratadas por NIC (Wright et al., 2001). Por consiguiente, los autores sugieren que se comunique a todas las mujeres que la crioterapia puede aumentar la transmisibilidad del VIH y que los condones son un medio eficaz de prevención. Conviene usarlos como mínimo durante 4 semanas, pero mejor durante 6. Lo ideal sería disponer de condones gratuitos en los consultorios de colposcopia en los entornos donde la infección por VIH es endémica.
Se debe programar una visita de seguimiento entre 9 y 12 meses después del tratamiento. Para el seguimiento, se harán citología o IVA, seguidas de colposcopia y biopsia dirigida según lo observado en la colposcopia, para evaluar la remisión o la persistencia de las lesiones. Si persisten, se repetirá el tratamiento. A las mujeres sin neoplasia se las puede orientar a un programa de tamizaje (si existe) o a seguimiento después de 3 ó 5 años.
 Figura 12.7 : a) Bola de hielo en ...
Figura 12.7 : a) Bola de hielo en ...Fracaso de la crioterapia
El tratamiento fracasa en cerca del 5 al 10% de las
mujeres, como se comprueba en el primer año de
seguimiento. Estas lesiones persistentes, locales o
multifocales son más probables cuando la lesión
original ha sido amplia. Para descartar el carcinoma
invasor no sospechado, es aconsejable biopsiar todas
las lesiones persistentes y volver a tratar con
crioterapia, LEEP o conización en frío, según convenga.
La evaluación de seguimiento puede llevarse a cabo
entre los 9 y 12 meses posteriores, y consistirá en
exámenes como la citología o la IVA y la colposcopia. A
las mujeres sin neoplasia se las puede orientar a un
programa de tamizaje (si existe en la zona) o a
seguimiento después de 3 ó 5 años. En la figura 11.1 se
presenta un enfoque de gestión en entornos de bajos
recursos.
 Cuadro 11.1 : Tratamiento de las i...
Cuadro 11.1 : Tratamiento de las i...Efectos adversos, complicaciones y secuelas a largo plazo
La crioterapia es generalmente un procedimiento
indoloro; si se ha tranquilizado bien a la paciente, ella
coopera y el procedimiento se lleva a cabo
adecuadamente. Algunas mujeres pueden tener cólicos
o dolores hipogástricos durante la crioterapia y después
de ella. De vez en cuando puede producirse un desmayo
por reacción vasovagal. En tal situación, no hay que
perder la calma; estas pacientes se reaniman
fácilmente. Las hemorragias consecutivas a la
crioterapia son muy poco frecuentes.
Estas pacientes pueden presentar exudado vaginal acuoso durante 3 ó 4 semanas después del tratamiento. La hemorragia vaginal es muy poco frecuente; es más probable si la congelación ha sido demasiado brusca y la bola de hielo ha sobrepasado los 5 mm de profundidad. El riesgo de infección posoperatoria es muy pequeño, y seguramente puede reducirse aún más posponiendo la crioterapia hasta que, ante un diagnóstico probable de enfermedad pélvica inflamatoria (EPI), cervicitis de transmisión sexual (por ejemplo, clamidiasis o gonorrea), tricomoniasis vaginal o vaginosis bacteriana, se ha tratado adecuadamente a la mujer y esta se ha recuperado. Si una mujer presenta en el posoperatorio un exudado hediondo, dolor pélvico y fiebre, conviene hacer un cultivo del exudado, si es posible, y se prescribirá un tratamiento empírico con antibióticos eficaces para la EPI. Si se diagnostica EPI, cervicitis de transmisión sexual o tricomoniasis, la pareja de la mujer también debe recibir tratamiento. En los países en desarrollo, puede considerarse la posibilidad de administrar sistemáticamente un tratamiento antibiótico empírico tras la crioterapia (doxiciclina 100 mg por vía oral, 2 veces al día, durante 7 días y metronidazol 400 mg por vía oral, 3 veces al día, durante 7 días).
Se produce estenosis del conducto cervical en menos del 1% de las pacientes y una reducción del flujo mucoso entre el 5 y 10% de ellas. La crioterapia no tiene efectos adversos conocidos sobre la fecundidad y el embarazo. En raras ocasiones se ha detectado un cáncer invasor después de la crioterapia. Esto suele deberse a un diagnóstico previo deficiente.
Estas pacientes pueden presentar exudado vaginal acuoso durante 3 ó 4 semanas después del tratamiento. La hemorragia vaginal es muy poco frecuente; es más probable si la congelación ha sido demasiado brusca y la bola de hielo ha sobrepasado los 5 mm de profundidad. El riesgo de infección posoperatoria es muy pequeño, y seguramente puede reducirse aún más posponiendo la crioterapia hasta que, ante un diagnóstico probable de enfermedad pélvica inflamatoria (EPI), cervicitis de transmisión sexual (por ejemplo, clamidiasis o gonorrea), tricomoniasis vaginal o vaginosis bacteriana, se ha tratado adecuadamente a la mujer y esta se ha recuperado. Si una mujer presenta en el posoperatorio un exudado hediondo, dolor pélvico y fiebre, conviene hacer un cultivo del exudado, si es posible, y se prescribirá un tratamiento empírico con antibióticos eficaces para la EPI. Si se diagnostica EPI, cervicitis de transmisión sexual o tricomoniasis, la pareja de la mujer también debe recibir tratamiento. En los países en desarrollo, puede considerarse la posibilidad de administrar sistemáticamente un tratamiento antibiótico empírico tras la crioterapia (doxiciclina 100 mg por vía oral, 2 veces al día, durante 7 días y metronidazol 400 mg por vía oral, 3 veces al día, durante 7 días).
Se produce estenosis del conducto cervical en menos del 1% de las pacientes y una reducción del flujo mucoso entre el 5 y 10% de ellas. La crioterapia no tiene efectos adversos conocidos sobre la fecundidad y el embarazo. En raras ocasiones se ha detectado un cáncer invasor después de la crioterapia. Esto suele deberse a un diagnóstico previo deficiente.



