Home / Training / Manuals / La colposcopia y el tratamiento de la neoplasia intraepitelial cervical: Manual para principiantes / Capítulo 13: Tratamiento de la neoplasia intraepitelial cervical mediante escición electroquirúrgica con asa (LEEP
 Cuadro 13.1 : Criterios de admisib...
Cuadro 13.1 : Criterios de admisib... Cuadro 11.1 : Tratamiento de las i...
Cuadro 11.1 : Tratamiento de las i... Figura 13.3 : Bandeja de instrumen...
Figura 13.3 : Bandeja de instrumen... Figura 4.9 : Espéculo vaginal cubi...
Figura 4.9 : Espéculo vaginal cubi...
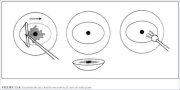 Figura 13.4 : Escisión de una lesi...
Figura 13.4 : Escisión de una lesi... Figura 13.5 : Escisión de una lesi...
Figura 13.5 : Escisión de una lesi...
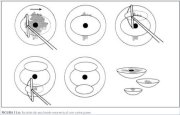 Figura 13.6 : Escisión de una lesi...
Figura 13.6 : Escisión de una lesi... Figura 13.3 : Bandeja de instrumen...
Figura 13.3 : Bandeja de instrumen...
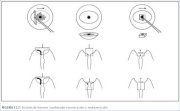 Figura 13.7 : Escisión de lesiones...
Figura 13.7 : Escisión de lesiones...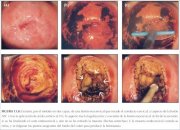 Figura 13.8 : Escisión, por el mét...
Figura 13.8 : Escisión, por el mét... Figura 13.4 : Escisión de una lesi...
Figura 13.4 : Escisión de una lesi... Figura 13.5 : Escisión de una lesi...
Figura 13.5 : Escisión de una lesi... Figura 13.6 : Escisión de una lesi...
Figura 13.6 : Escisión de una lesi... Figura 13.8 : Escisión, por el mét...
Figura 13.8 : Escisión, por el mét...
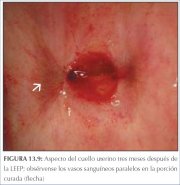 Figura 13.9 : Aspecto del cuello u...
Figura 13.9 : Aspecto del cuello u...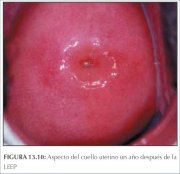 Figura 13.10 : Aspecto del cuello ...
Figura 13.10 : Aspecto del cuello ...
 table 11.1: Treatment for reproduc...
table 11.1: Treatment for reproduc...
La colposcopia y el tratamiento de la neoplasia intraepitelial cervical: Manual para principiantes, J.W. Sellors & R. Sankaranarayanan
Capítulo 13: Tratamiento de la neoplasia intraepitelial cervical mediante escición electroquirúrgica con asa (LEEP
Filter by language: English / Français / Español / Portugues / 中文- La corriente electroquirúrgica aplicada a los tejidos puede tener tres efectos sobre ellos, según la intensidad y la onda empleadas: desecación, corte o fulguración.
- La escisión electroquirúrgica con asa (LEEP) es un procedimiento relativamente sencillo que puede aprenderse fácilmente.
- La principal ventaja de la LEEP con respecto de la crioterapia es que extirpa el epitelio afectado, en vez de destruirlo, lo que permite su examen histológico.
- Hay que emplear un asa más ancha que la lesión o y la zona de transformación que deban extirparse; de lo contrario, hay que repetir la escisión varias veces.
- Si la lesión afecta al conducto cervical, debe usarse un método exerético en dos capas.
- Las mujeres presentarán un exudado marrón o negro hasta dos semanas después de la LEEP.
- Se les debe desaconsejar la ducha vaginal, los tampones y el coito durante un mes después del tratamiento.
- Menos del 2% de las mujeres tratadas presentan hemorragia posoperatoria moderada o intensa, a las que hay que atender con prontitud.
- La tasa de fracaso de la LEEP en mujeres tratadas por primera vez gira en torno al 10%.
La electrocirugía consiste en emplear corriente
eléctrica de radiofrecuencia para cortar tejidos o lograr
la hemostasia. Quien realiza la escisión
electroquirúrgica con asa (LEEP) debe recordar que la
electricidad se descarga en el suelo a través de la vía
que opone la menor resistencia. La energía eléctrica
empleada en electrocirugía se transforma en calor y en
energía lumínica. El calor generado por el arco eléctrico
de alto voltaje formado entre el electrodo y el tejido
permite al médico cortar tejido por vaporización (a
100°C) o coagularlo por deshidratación (por encima de
100°C). Los electrodos cortantes son asas de acero
inoxidable o alambre de tungsteno muy fino (0,2 mm)
que permiten cortar en diferentes anchos,
profundidades y configuraciones (figura 13.1).
Las temperaturas más elevadas de la coagulación producen efectos térmicos mayores que los del corte electroquirúrgico. Esto es importante en electrocirugía, pues para poder realizar un examen histopatológico adecuado, el efecto de coagulación en la muestra quirúrgica obtenida debe ser mínimo. Por otra parte, cierto efecto de coagulación es aconsejable, incluso al cortar, para minimizar la hemorragia en el campo quirúrgico. Los fabricantes de los generadores electroquirúrgicos modernos (figura 13.2) están conscientes de la necesidad de controlar la hemorragia. Proponen aparatos electroquirúrgicos que producen cierto nivel de coagulación mezclando corrientes eléctricas, una con una onda de corte y otra con una onda de coagulación. Esta combinación se llama onda mixta de corte, y a ella nos referiremos en este manual al hablar de escisión electroquirúrgica.
Al seleccionar la coagulación en el generador electroquirúrgico, la onda de coagulación tiene un voltaje mayor de máximo a máximo (lo que produce temperaturas mayores) que el de la onda de corte simple; con ello se busca únicamente calentar el tejido por encima de 100°C para lograr su deshidratación. Hay tres tipos de coagulación: la desecación, en la cual el electrodo activo toca el tejido; la fulguración, en la cual el electrodo activo no toca el tejido, sino que ‘nebuliza’ varias chispas entre él y el tejido; y la coagulación por punción, en la cual se inserta un electrodo, generalmente una aguja, en el centro de la lesión. En este manual nos referiremos, por regla general, a la coagulación en modo de fulguración con un electrodo de bola de 3 a 5 mm (con la excepción del recurso a un electrodo de aguja para fulgurar una zona de hemorragia pertinaz). En modo de fulguración, la onda de coagulación tiene un voltaje mayor de máximo a máximo que en otros modos, y coagula el tejido con menos electricidad, por lo que es menor el riesgo de dañar tejidos adyacentes.
Para obtener un efecto adecuado, el generador electroquirúrgico debe disponer de un electrodo de retorno de la paciente o una placa dispersiva para cerrar el circuito eléctrico y que se produzca el flujo óptimo de corriente. La placa dispersiva debe colocarse siempre lo más cerca posible de la zona quirúrgica, contrariamente al efecto deseado en el electrodo activo, donde se busca una alta densidad de corriente para concentrar la energía eléctrica que se transforma en el calor. Si no se mantiene un buen contacto eléctrico del electrodo dispersivo en una zona grande, la paciente puede sufrir una quemadura eléctrica en este lugar. Para que esto no ocurra, los equipos electroquirúrgicos modernos tienen un sistema de circuitos (comúnmente denominado sistema de monitoreo del electrodo de retorno) que vigila continuamente la adecuación de la conexión de la placa de tierra (almohadilla dispersiva) con la paciente. Este tipo de circuitos no solo alerta al operador de un problema, sino que también impide el funcionamiento del sistema hasta que se corrige el defecto. Para una electrocirugía segura y eficaz, es muy recomendable que el generador electroquirúrgico cumpla estas normas básicas. Se supone que para los procedimientos electroquirúrgicos descritos en este manual se empleará únicamente un sistema que cumpla tales requisitos o los exceda.
No se realizará electrocirugía en presencia de gases, anestésicos ni líquidos inflamables (por ejemplo, soluciones o tinturas alcohólicas para preparaciones cutáneas), de objetos inflamables, de oxidantes ni en una atmósfera enriquecida por oxígeno. Por supuesto, el operador corre el riesgo de quemarse con el electrodo activo si lo toca cuando está en esa fase.
Las temperaturas más elevadas de la coagulación producen efectos térmicos mayores que los del corte electroquirúrgico. Esto es importante en electrocirugía, pues para poder realizar un examen histopatológico adecuado, el efecto de coagulación en la muestra quirúrgica obtenida debe ser mínimo. Por otra parte, cierto efecto de coagulación es aconsejable, incluso al cortar, para minimizar la hemorragia en el campo quirúrgico. Los fabricantes de los generadores electroquirúrgicos modernos (figura 13.2) están conscientes de la necesidad de controlar la hemorragia. Proponen aparatos electroquirúrgicos que producen cierto nivel de coagulación mezclando corrientes eléctricas, una con una onda de corte y otra con una onda de coagulación. Esta combinación se llama onda mixta de corte, y a ella nos referiremos en este manual al hablar de escisión electroquirúrgica.
Al seleccionar la coagulación en el generador electroquirúrgico, la onda de coagulación tiene un voltaje mayor de máximo a máximo (lo que produce temperaturas mayores) que el de la onda de corte simple; con ello se busca únicamente calentar el tejido por encima de 100°C para lograr su deshidratación. Hay tres tipos de coagulación: la desecación, en la cual el electrodo activo toca el tejido; la fulguración, en la cual el electrodo activo no toca el tejido, sino que ‘nebuliza’ varias chispas entre él y el tejido; y la coagulación por punción, en la cual se inserta un electrodo, generalmente una aguja, en el centro de la lesión. En este manual nos referiremos, por regla general, a la coagulación en modo de fulguración con un electrodo de bola de 3 a 5 mm (con la excepción del recurso a un electrodo de aguja para fulgurar una zona de hemorragia pertinaz). En modo de fulguración, la onda de coagulación tiene un voltaje mayor de máximo a máximo que en otros modos, y coagula el tejido con menos electricidad, por lo que es menor el riesgo de dañar tejidos adyacentes.
Para obtener un efecto adecuado, el generador electroquirúrgico debe disponer de un electrodo de retorno de la paciente o una placa dispersiva para cerrar el circuito eléctrico y que se produzca el flujo óptimo de corriente. La placa dispersiva debe colocarse siempre lo más cerca posible de la zona quirúrgica, contrariamente al efecto deseado en el electrodo activo, donde se busca una alta densidad de corriente para concentrar la energía eléctrica que se transforma en el calor. Si no se mantiene un buen contacto eléctrico del electrodo dispersivo en una zona grande, la paciente puede sufrir una quemadura eléctrica en este lugar. Para que esto no ocurra, los equipos electroquirúrgicos modernos tienen un sistema de circuitos (comúnmente denominado sistema de monitoreo del electrodo de retorno) que vigila continuamente la adecuación de la conexión de la placa de tierra (almohadilla dispersiva) con la paciente. Este tipo de circuitos no solo alerta al operador de un problema, sino que también impide el funcionamiento del sistema hasta que se corrige el defecto. Para una electrocirugía segura y eficaz, es muy recomendable que el generador electroquirúrgico cumpla estas normas básicas. Se supone que para los procedimientos electroquirúrgicos descritos en este manual se empleará únicamente un sistema que cumpla tales requisitos o los exceda.
No se realizará electrocirugía en presencia de gases, anestésicos ni líquidos inflamables (por ejemplo, soluciones o tinturas alcohólicas para preparaciones cutáneas), de objetos inflamables, de oxidantes ni en una atmósfera enriquecida por oxígeno. Por supuesto, el operador corre el riesgo de quemarse con el electrodo activo si lo toca cuando está en esa fase.
Adquirir competencia en LEEP antes de practicarla a las pacientes
Todo colposcopista tiene que haber practicado la LEEP y
demostrado su capacidad para realizarla adecuadamente
simulando la escisión de lesiones cervicales en carne (de
vacuno, de cerdo, etc.) o en frutas en las cuales se han
pintado lesiones ficticias a escala. El líquido corrector de
tipografía o el ácido tricloroacético sirven para simular
dichas lesiones. Siempre debe practicarse la LEEP usando
el colposcopio, como se hace en situación real. Si es
posible, los colposcopistas deben tener experiencia y
competencia demostradas en crioterapia antes de
aprender la LEEP.
La LEEP, paso a paso
En primer lugar, debe confirmarse que la mujer cumple
los criterios de admisibilidad expuestos en el cuadro
13.1.
Si hay indicios de enfermedad pélvica inflamatoria (EPI), cervicitis, tricomoniasis vaginal, vaginosis bacteriana o úlcera anogenital, es aconsejable retrasar la LEEP hasta haber tratado y resuelto la afección (véase el capítulo 11, cuadro 11.1). Si una mujer mayor presenta atrofia pronunciada por deficiencia de estrógeno y tinción indiferenciada del margen exterior de una lesión, es aconsejable retrasar la LEEP hasta después de haber hecho un tratamiento tópico con estrógenos.
En general, es preferible que el diagnóstico de NIC esté firmemente establecido antes de proceder a la LEEP. Puede, no obstante, haber excepciones a esta regla general. Por ejemplo, en los países en desarrollo, puede ofrecerse tratamiento a las mujeres en su primera visita de colposcopia para maximizar la cobertura (de no hacerlo, las que no se presentan a seguimiento no recibirán tratamiento de sus lesiones). Los colposcopistas expertos, en ciertos entornos clínicos, pueden también emplear este enfoque para maximizar la cobertura del tratamiento y minimizar el número de consultas.
El instrumental para la LEEP se colocará en un carrito o bandeja (figura 13.3). Si la mujer vuelve a la consulta para una segunda visita de tratamiento, hay que proceder a una evaluación colposcópica inmediatamente antes de la LEEP para confirmar que la ubicación y la longitud de la lesión permiten una intervención eficaz. La lugolización es útil para delimitar los márgenes de la lesión antes de comenzar el tratamiento. Hay que usar un espéculo vaginal (figura 13.3) con aislamiento eléctrico o un espéculo metálico aislado con condón de látex (figura 4.9) para prevenir el choque eléctrico de la paciente si el electrodo activo toca accidentalmente el espéculo (aunque esto no suele causar daño tisular, pues la zona de contacto es relativamente grande). También hay que tener cuidado para no producir dolor al tocar involuntariamente las paredes vaginales con el electrodo activo. Esto último puede evitarse usando un retractor de las paredes laterales vaginales asimismo aislado, además de un espéculo vaginal aislado (figura 13.3), o un espéculo asilado con un condón (figura 4.9).
Lo ideal es que el espéculo vaginal disponga de un tubo evacuador de humo en la superficie luminal de la paleta anterior, al que pueda acoplarse un mecanismo de aspiración. Si no se dispone de este tipo de espéculo, puede emplearse un simple tubo de succión (preferentemente de material no conductor y no inflamable), con su punta abierta lo más cerca posible del cuello uterino. Es obligatorio disponer de un sistema de extracción de humos de alto flujo y con filtro para las partículas de humo y los olores.
La anestesia local se alcanza a los 30 segundos de aplicar varias inyecciones de un total de hasta 5 ml de xilocaína al 1% (o un agente similar) en el tejido estrómico del exocérvix. Las inyecciones se administran en torno a la periferia de la lesión y la zona de transformación (en la posición de las 3, las 6, las 9 y las 12 del reloj), con una profundidad de 1 a 2 mm, usando una jeringa de 5 ml y una aguja de calibre 25 a 27. Para reducir la hemorragia durante el procedimiento suele añadirse un vasoconstrictor, como la vasopresina (no más de una unidad), al anestésico local que se inyecta. Para la anestesia local también puede usarse xilocaína con adrenalina al 2% en vez de pitresina, aunque puede causar palpitaciones y temblores de la pierna antes de la intervención. Esto puede evitarse mediante una infiltración subepitelial. Si se prevé una escisión en dos capas (cono de LEEP), el anestésico local se inyecta también en el conducto cervical anterior y posterior.
El objetivo de la LEEP es extirpar las lesiones y la zona de transformación en su totalidad y enviar el tejido afectado al laboratorio de histopatología para su estudio. Hay que usar la mínima cantidad de corriente necesaria para una electrocirugía eficaz, para reducir al mínimo el riesgo de los tejidos no afectados de la paciente y que la muestra extirpada esté en condición aceptable (con un mínimo de artefacto térmico) para el estudio histopatológico. La potencia empleada depende del tamaño del electrodo que corta el tejido y de si va a aplicarse fulguración. Todo esto debe determinarse previamente en la consulta y comunicarse al operador de LEEP que elegirá una potencia del generador para cortar o para fulgurar. Las potencias habituales para los diferentes electrodos del asa son las siguientes: 1,0 x 1,0 cm 30 vatios; 1,5 x 0,5 cm 35 vatios; 2,0 x 0,8 cm 40 vatios; 2,0 x 1,2 cm 50 vatios. Las potencias para los electrodos de bola de 3 mm y de 5 mm son 30 vatios y 50 vatios, respectivamente, en modo de coagulación. Cuando sea posible, una lesión debe extirparse con un solo paso del asa, aunque esto no siempre es factible. Se describen a continuación cuatro casos operatorios básicos:
Si hay indicios de enfermedad pélvica inflamatoria (EPI), cervicitis, tricomoniasis vaginal, vaginosis bacteriana o úlcera anogenital, es aconsejable retrasar la LEEP hasta haber tratado y resuelto la afección (véase el capítulo 11, cuadro 11.1). Si una mujer mayor presenta atrofia pronunciada por deficiencia de estrógeno y tinción indiferenciada del margen exterior de una lesión, es aconsejable retrasar la LEEP hasta después de haber hecho un tratamiento tópico con estrógenos.
En general, es preferible que el diagnóstico de NIC esté firmemente establecido antes de proceder a la LEEP. Puede, no obstante, haber excepciones a esta regla general. Por ejemplo, en los países en desarrollo, puede ofrecerse tratamiento a las mujeres en su primera visita de colposcopia para maximizar la cobertura (de no hacerlo, las que no se presentan a seguimiento no recibirán tratamiento de sus lesiones). Los colposcopistas expertos, en ciertos entornos clínicos, pueden también emplear este enfoque para maximizar la cobertura del tratamiento y minimizar el número de consultas.
El instrumental para la LEEP se colocará en un carrito o bandeja (figura 13.3). Si la mujer vuelve a la consulta para una segunda visita de tratamiento, hay que proceder a una evaluación colposcópica inmediatamente antes de la LEEP para confirmar que la ubicación y la longitud de la lesión permiten una intervención eficaz. La lugolización es útil para delimitar los márgenes de la lesión antes de comenzar el tratamiento. Hay que usar un espéculo vaginal (figura 13.3) con aislamiento eléctrico o un espéculo metálico aislado con condón de látex (figura 4.9) para prevenir el choque eléctrico de la paciente si el electrodo activo toca accidentalmente el espéculo (aunque esto no suele causar daño tisular, pues la zona de contacto es relativamente grande). También hay que tener cuidado para no producir dolor al tocar involuntariamente las paredes vaginales con el electrodo activo. Esto último puede evitarse usando un retractor de las paredes laterales vaginales asimismo aislado, además de un espéculo vaginal aislado (figura 13.3), o un espéculo asilado con un condón (figura 4.9).
Lo ideal es que el espéculo vaginal disponga de un tubo evacuador de humo en la superficie luminal de la paleta anterior, al que pueda acoplarse un mecanismo de aspiración. Si no se dispone de este tipo de espéculo, puede emplearse un simple tubo de succión (preferentemente de material no conductor y no inflamable), con su punta abierta lo más cerca posible del cuello uterino. Es obligatorio disponer de un sistema de extracción de humos de alto flujo y con filtro para las partículas de humo y los olores.
La anestesia local se alcanza a los 30 segundos de aplicar varias inyecciones de un total de hasta 5 ml de xilocaína al 1% (o un agente similar) en el tejido estrómico del exocérvix. Las inyecciones se administran en torno a la periferia de la lesión y la zona de transformación (en la posición de las 3, las 6, las 9 y las 12 del reloj), con una profundidad de 1 a 2 mm, usando una jeringa de 5 ml y una aguja de calibre 25 a 27. Para reducir la hemorragia durante el procedimiento suele añadirse un vasoconstrictor, como la vasopresina (no más de una unidad), al anestésico local que se inyecta. Para la anestesia local también puede usarse xilocaína con adrenalina al 2% en vez de pitresina, aunque puede causar palpitaciones y temblores de la pierna antes de la intervención. Esto puede evitarse mediante una infiltración subepitelial. Si se prevé una escisión en dos capas (cono de LEEP), el anestésico local se inyecta también en el conducto cervical anterior y posterior.
El objetivo de la LEEP es extirpar las lesiones y la zona de transformación en su totalidad y enviar el tejido afectado al laboratorio de histopatología para su estudio. Hay que usar la mínima cantidad de corriente necesaria para una electrocirugía eficaz, para reducir al mínimo el riesgo de los tejidos no afectados de la paciente y que la muestra extirpada esté en condición aceptable (con un mínimo de artefacto térmico) para el estudio histopatológico. La potencia empleada depende del tamaño del electrodo que corta el tejido y de si va a aplicarse fulguración. Todo esto debe determinarse previamente en la consulta y comunicarse al operador de LEEP que elegirá una potencia del generador para cortar o para fulgurar. Las potencias habituales para los diferentes electrodos del asa son las siguientes: 1,0 x 1,0 cm 30 vatios; 1,5 x 0,5 cm 35 vatios; 2,0 x 0,8 cm 40 vatios; 2,0 x 1,2 cm 50 vatios. Las potencias para los electrodos de bola de 3 mm y de 5 mm son 30 vatios y 50 vatios, respectivamente, en modo de coagulación. Cuando sea posible, una lesión debe extirparse con un solo paso del asa, aunque esto no siempre es factible. Se describen a continuación cuatro casos operatorios básicos:
 Cuadro 13.1 : Criterios de admisib...
Cuadro 13.1 : Criterios de admisib... Cuadro 11.1 : Tratamiento de las i...
Cuadro 11.1 : Tratamiento de las i... Figura 13.3 : Bandeja de instrumen...
Figura 13.3 : Bandeja de instrumen... Figura 4.9 : Espéculo vaginal cubi...
Figura 4.9 : Espéculo vaginal cubi...Escisión de una lesión exocervical con un solo pase del asa (figuras 13.4 y 13.5)
Hay que emplear un asa más ancha que la lesión y la
zona de transformación que deban extirparse. El asa
tiene que tener un mínimo de 5 mm de altura (del
mango a la parte más alejada del alambre). Suele poder
emplearse un asa oval de 2,0 x 0,8 cm. Para conseguir
la forma y profundidad ideales del corte, conviene
mantener el mango del electrodo perpendicular a la
superficie del exocérvix, es decir, el travesaño paralelo
al exocérvix. Para empezar, se administra anestesia
local; en el generador electroquirúrgico se selecciona la
potencia apropiada para el modo de corte mixto, y se
prende el sistema de extracción de humos. Cuando está
a punto de comenzar la incisión con el asa, antes de
tocar la superficie cervicouterina, el operador activa la
corriente mediante un pedal o accionando con el dedo
el interruptor del mango del electrodo. El asa se
introduce en el tejido 5mm por fuera del límite exterior
de la lesión. Es importante no empujar el electrodo,
sino dejar que vaya cortando; el operador sencillamente
decide la dirección. El asa va penetrando gradualmente
en el cuello uterino hasta que el travesaño está casi en
contacto con la superficie epitelial. Luego se guía el asa
de forma paralela a la superficie (horizontal o
verticalmente, según la dirección de corte) hasta
alcanzar con exactitud la parte exterior del borde
opuesto de la lesión. Entonces se retira lentamente el
asa, manteniéndola perpendicular a la superficie. En
cuanto el asa sale del tejido, se apaga la corriente. No
importa si la escisión se hace de derecha a izquierda o
viceversa. También es aceptable pasar el asa de atrás
hacia adelante. En cambio, no es aceptable pasarla de
delante hacia atrás, pues la hemorragia o el propio
tejido extirpado pueden quedar colgando y ocultar el
campo visual.
Una vez que se ha extirpado el tejido y colocado en formalina, en el generador electroquirúrgico se selecciona la potencia apropiada para el modo de fulguración. Se fulgura la superficie de la herida quirúrgica con un electrodo de bola de 3 o de 5 mm, en modo de coagulación. También hay que fulgurar los bordes de la herida quirúrgica para preservar la unión escamoso-cilíndrica en el exocérvix visible. Si se produce una hemorragia que dificulta el control del electrodo de bola, suele ser útil recurrir a un electrodo de macroaguja para fulgurar una zona hemorrágica de modo mucho más concentrado (mayor densidad de corriente) y localizado. Si se consigue una hemostasia satisfactoria, se impregna la superficie de la herida quirúrgica con solución de Monsel y se retira el espéculo. Suele observarse que una paciente muy nerviosa tiende a sangrar más que una relajada, lo que es otra buena razón para comunicarse con la paciente durante toda la intervención y tratar de calmar sus temores.
Si, pese a todo, es difícil detener la hemorragia, hay que impregnar profusamente la base de la herida quirúrgica con solución de Monsel y llenar la vagina de gasa. La mujer deberá esperar varias horas antes de retirar la gasa. Esta complicación se presenta con mayor frecuencia en mujeres con cervicitis.
Una vez que se ha extirpado el tejido y colocado en formalina, en el generador electroquirúrgico se selecciona la potencia apropiada para el modo de fulguración. Se fulgura la superficie de la herida quirúrgica con un electrodo de bola de 3 o de 5 mm, en modo de coagulación. También hay que fulgurar los bordes de la herida quirúrgica para preservar la unión escamoso-cilíndrica en el exocérvix visible. Si se produce una hemorragia que dificulta el control del electrodo de bola, suele ser útil recurrir a un electrodo de macroaguja para fulgurar una zona hemorrágica de modo mucho más concentrado (mayor densidad de corriente) y localizado. Si se consigue una hemostasia satisfactoria, se impregna la superficie de la herida quirúrgica con solución de Monsel y se retira el espéculo. Suele observarse que una paciente muy nerviosa tiende a sangrar más que una relajada, lo que es otra buena razón para comunicarse con la paciente durante toda la intervención y tratar de calmar sus temores.
Si, pese a todo, es difícil detener la hemorragia, hay que impregnar profusamente la base de la herida quirúrgica con solución de Monsel y llenar la vagina de gasa. La mujer deberá esperar varias horas antes de retirar la gasa. Esta complicación se presenta con mayor frecuencia en mujeres con cervicitis.
 Figura 13.4 : Escisión de una lesi...
Figura 13.4 : Escisión de una lesi... Figura 13.5 : Escisión de una lesi...
Figura 13.5 : Escisión de una lesi...Escisión de una lesión exocervical con varios pases del asa (figura 13.6)
Si el diámetro de una lesión excede el ancho del asa más
grande (generalmente 2 cm), la lesión debe extraerse
con varios pases de asas que pueden ser de tamaños
diferentes. Mediante el método básico descrito (figura
13.3), suele extirparse primero la parte central de la
lesión. Se extirpan después las restantes partes
periféricas de la lesión, con uno o varios pases. Se
guardan todas las muestras para estudio
histopatológico.
 Figura 13.6 : Escisión de una lesi...
Figura 13.6 : Escisión de una lesi... Figura 13.3 : Bandeja de instrumen...
Figura 13.3 : Bandeja de instrumen...Escisión de lesiones combinadas exocervicales y endocervicales (figuras 13.7 y 13.8)
Para una lesión con afectación del conducto cervical y
cuya extirpación no sea probable con la profundidad del
pase único descrito (figuras 13.4 y 13.5), puede
recurrirse a un método de escisión en dos capas. Las
mayoría de las lesiones que invaden el conducto
cervical suelen penetrar en él 1 cm o menos. Las
mujeres mayores y las que tienen NIC 3 suelen presentar
lesiones más largas, cuya exéresis requiere un segundo
pase, de la totalidad del conducto cervical.
Generalmente, la porción exocervical de este tipo de lesión que invade el conducto puede extirparse con un asa oval grande (2,0 x 0,8 cm). El resto del tejido del conducto cervical puede extirparse con un asa más pequeña, que suele consistir en un cuadrado de 1,0 cm de lado, pero llevando cuidado de no profundizar más de lo necesario para extirpar completamente la lesión y un margen de tejido normal. Este tipo de escisión puede penetrar hasta 1,6 cm en el conducto cervical (figura 13.7), y solo debe intentarse cuando sea absolutamente necesario, porque el riesgo de hemorragia y estenosis aumenta en proporción directa a la profundidad de la escisión. No debe practicarse la LEEP si no puede verse el límite distal o craneal de la lesión, o si la parte distal de la lesión penetra más de 1 cm en el conducto. A estas pacientes debe practicárseles conización con bisturí frío. Como este método en dos pasos requiere destreza con la LEEP básica, se recomienda no intentarlo hasta que el operador esté bien familiarizado con esta LEEP. A las mujeres que presentan lesiones con penetración más profunda en el conducto hay que practicarles conización con bisturí frío para estudiar adecuadamente el conducto cervical.
Generalmente, la porción exocervical de este tipo de lesión que invade el conducto puede extirparse con un asa oval grande (2,0 x 0,8 cm). El resto del tejido del conducto cervical puede extirparse con un asa más pequeña, que suele consistir en un cuadrado de 1,0 cm de lado, pero llevando cuidado de no profundizar más de lo necesario para extirpar completamente la lesión y un margen de tejido normal. Este tipo de escisión puede penetrar hasta 1,6 cm en el conducto cervical (figura 13.7), y solo debe intentarse cuando sea absolutamente necesario, porque el riesgo de hemorragia y estenosis aumenta en proporción directa a la profundidad de la escisión. No debe practicarse la LEEP si no puede verse el límite distal o craneal de la lesión, o si la parte distal de la lesión penetra más de 1 cm en el conducto. A estas pacientes debe practicárseles conización con bisturí frío. Como este método en dos pasos requiere destreza con la LEEP básica, se recomienda no intentarlo hasta que el operador esté bien familiarizado con esta LEEP. A las mujeres que presentan lesiones con penetración más profunda en el conducto hay que practicarles conización con bisturí frío para estudiar adecuadamente el conducto cervical.
 Figura 13.7 : Escisión de lesiones...
Figura 13.7 : Escisión de lesiones... Figura 13.8 : Escisión, por el mét...
Figura 13.8 : Escisión, por el mét... Figura 13.4 : Escisión de una lesi...
Figura 13.4 : Escisión de una lesi... Figura 13.5 : Escisión de una lesi...
Figura 13.5 : Escisión de una lesi... Figura 13.6 : Escisión de una lesi...
Figura 13.6 : Escisión de una lesi... Figura 13.8 : Escisión, por el mét...
Figura 13.8 : Escisión, por el mét...Seguimiento de la LEEP
Hay que decirles a las mujeres cómo deben cuidarse y
qué síntomas pueden tener después del tratamiento, en
su caso particular, por escrito. Hay que explicarles que
tendrán un exudado pardo o negro que durará entre
unos pocos días y dos semanas, que deberán consultar
con prontitud si persiste más de dos semanas, si se hace
maloliente o si tienen dolores en la parte inferior del
abdomen o hemorragia profusa. Se les debe
desaconsejar la ducha vaginal, los tampones y el coito
durante un mes después del tratamiento. En las figuras
13.9 y 13.10 se muestra el aspecto del cuello uterino a
los tres y a los doce meses de realizada la LEEP.
No se conoce el efecto de la LEEP sobre la posible transmisibilidad, de o a las mujeres, de la infección por el virus de la inmunodeficiencia humana (VIH) durante la fase de curación. Ha podido ponerse de manifiesto la eliminación de VIH-1 en las secreciones vaginales de seropositivas tratadas por NIC (Wright et al., 2001). Por consiguiente, los autores sugieren que se comunique a todas las mujeres que la LEEP puede aumentar la transmisibilidad del VIH y que los condones son un medio eficaz de prevención. Hay que usar condones entre 6 y 8 semanas. Lo ideal sería disponer de condones gratuitos en los consultorios de colposcopia en los entornos donde la infección por VIH es endémica.
Hay que dar cita de seguimiento entre los 9 y 12 meses posteriores al tratamiento; el plan de manejo seguirá el esquema presentado en el capítulo 11. En la próxima sección se aborda la pauta a seguir ante lesiones cuya persistencia se comprueba en las visitas de seguimiento.
No se conoce el efecto de la LEEP sobre la posible transmisibilidad, de o a las mujeres, de la infección por el virus de la inmunodeficiencia humana (VIH) durante la fase de curación. Ha podido ponerse de manifiesto la eliminación de VIH-1 en las secreciones vaginales de seropositivas tratadas por NIC (Wright et al., 2001). Por consiguiente, los autores sugieren que se comunique a todas las mujeres que la LEEP puede aumentar la transmisibilidad del VIH y que los condones son un medio eficaz de prevención. Hay que usar condones entre 6 y 8 semanas. Lo ideal sería disponer de condones gratuitos en los consultorios de colposcopia en los entornos donde la infección por VIH es endémica.
Hay que dar cita de seguimiento entre los 9 y 12 meses posteriores al tratamiento; el plan de manejo seguirá el esquema presentado en el capítulo 11. En la próxima sección se aborda la pauta a seguir ante lesiones cuya persistencia se comprueba en las visitas de seguimiento.
 Figura 13.9 : Aspecto del cuello u...
Figura 13.9 : Aspecto del cuello u... Figura 13.10 : Aspecto del cuello ...
Figura 13.10 : Aspecto del cuello ...Adverse effects, complications, and long-term sequelae of LEEP
Most women experience some transitory pain from the injection of local
anaesthetic into the cervix. Severe perioperative bleeding occurs after 2% or less of LEEP procedures. Women should be advised to contact the clinic if they have any concerns during the post-operative
period. It is advisable to give written post-operative instructions that outline the following points. Few women complain of post-operative pain. If post-operative pain occurs, it usually is similar to
cramps; women should be instructed to use oral analgesics such as acetaminophen or ibuprofen, if necessary. A blood-tinged, dark brown (from the Monsel’s paste) mucus discharge usually lasts for one or two
weeks after treatment. Severe and moderate post-operative bleeding occurs in a few women, who should be seen promptly. Healing after LEEP usually takes place within a month.
When post- operative bleeding occurs, it usually appears 4-6 days after treatment and often from the posterior lip of cervix. This bleeding can usually be controlled by fulguration, applying Monsel’s paste, or using a silver nitrate applicator stick. Rarely, placement of a suture at the bleeding site is necessary. The risk of post-operative infection is very small and can probably be reduced even more by delaying surgical treatment until any woman with a likely diagnosis of PID, cervicitis, vaginal trichomoniasis or bacterial vaginosis has been adequately treated and recovered. If a woman presents post-operatively with a malodorous discharge, it should be cultured if possible and empirical treatment prescribed with antibiotics that are effective for PID (see Table 11.1). In developing countries, it may be preferable to institute routine presumptive treatment with antibiotics after LEEP (doxycycline 100 mg orally, two times a day, for seven days and metronidazole 400 mg orally, three times a day, for seven days).
The squamocolumnar junction is in the endocervical canal at the follow-up evaluation in approximately 2% of women. This presents a challenge for adequate colposcopic examination and cytological sampling. Women should be warned that cervical stenosis, partial or complete, is rarely encountered (probably less than 1%), but is more common in menopausal women.
When post- operative bleeding occurs, it usually appears 4-6 days after treatment and often from the posterior lip of cervix. This bleeding can usually be controlled by fulguration, applying Monsel’s paste, or using a silver nitrate applicator stick. Rarely, placement of a suture at the bleeding site is necessary. The risk of post-operative infection is very small and can probably be reduced even more by delaying surgical treatment until any woman with a likely diagnosis of PID, cervicitis, vaginal trichomoniasis or bacterial vaginosis has been adequately treated and recovered. If a woman presents post-operatively with a malodorous discharge, it should be cultured if possible and empirical treatment prescribed with antibiotics that are effective for PID (see Table 11.1). In developing countries, it may be preferable to institute routine presumptive treatment with antibiotics after LEEP (doxycycline 100 mg orally, two times a day, for seven days and metronidazole 400 mg orally, three times a day, for seven days).
The squamocolumnar junction is in the endocervical canal at the follow-up evaluation in approximately 2% of women. This presents a challenge for adequate colposcopic examination and cytological sampling. Women should be warned that cervical stenosis, partial or complete, is rarely encountered (probably less than 1%), but is more common in menopausal women.
 table 11.1: Treatment for reproduc...
table 11.1: Treatment for reproduc...Pauta a seguir ante lesiones cuya persistencia se comprueba en las visitas de seguimiento
Hay que proceder al seguimiento de todas las mujeres
entre los 9 y 12 meses posteriores al tratamiento,
independientemente de que el informe anatomopatológico
declare que los bordes exeréticos no están afectados, para
evaluar la regresión o la persistencia de lesiones y
complicaciones. Se detectan fracasos del tratamiento
(lesiones persistentes en la visita de seguimiento) en menos
de 10% de las mujeres controladas. Para descartar la
presencia de carcinoma invasor no sospechado, es
aconsejable biopsiar todas las lesiones persistentes. Estas
últimas deben volverse a tratar con crioterapia, LEEP o
conización en frío, según convenga.



