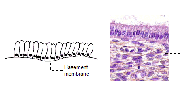Accueil / Formation / Manuels / Guide pratique pour le dépistage des néoplasies cervicales / Bases anatomiques et pathologiques de l’inspection visuelle
 /
/ 
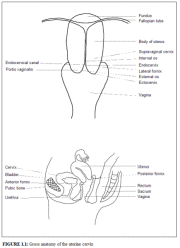
fig 1.1: Anatomie générale du col utérin
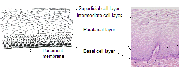
fig 1.2: Epithélium pavimenteux stratifié (x20)
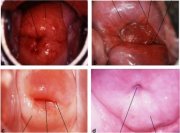
fig 1.4: Localisation de la jonction pavimento-cylindrique (JPC)
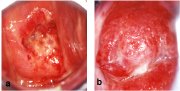
fig 1.7: (a) Inflammation du col accompagnée d’une ulcération, de saignements, d’une nécrose, de pertes jaune verdâtre et d’un exsudat inflammatoire / (b) Col enflammé, très rouge, ayant perdu ses villosités au niveau de l’épithélium cylindrique, et recouvert d’un exsudat inflammatoire.

table 1: Corrélation entre CIN, dysplasie et la terminologie Bethesda.
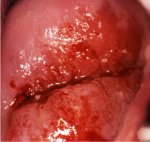
fig 1.11: Cancer invasif débutant du col: noter sa surface nodulaire, irrégulière, granuleuse, et saignant au toucher.
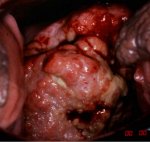
fig 1.12: Cancer invasif du col à un stade avancé: noter la tumeur ulcéroproliférative protubérante, semblable à un chou-fleur, les saignements et la nécrose.
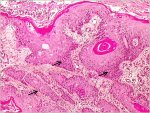
fig 1.13: Histologie - Carcinome épidermoïde invasif kératinisant bien différencié (?10). Noter l’invasion du stroma par des groupes de cellules malignes.
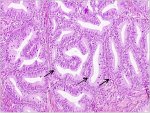
fig 1.14: Histologie - Adénocarcinome invasif bien différencié. Noter les cellules malignes qui bordent les cryptes cervicales (x20)
Guide pratique pour le dépistage des néoplasies cervicales
Chapitre 1 / Bases anatomiques et pathologiques de l’inspection visuelle avec l’acide acétique (IVA) et avec le soluté de Lugol (IVL)
Autre langue : English / Français / Español / Turkish / /
/ 
Introduction
L’inspection du col utérin à l’œil nu, après application d’acide acétique à 5% (IVA) et/ou de soluté de Lugol (IVL), constitue un test simple de détection précoce des lésions cervicales précancéreuses et du cancer invasif débutant. L’IVL correspond au test de Schiller à l’iode utilisé dans les années 1930 et 1940 pour détecter les néoplasies cervicales. Par la suite, ce test a été abandonné au profit des tests cytologiques lorsque ceux-ci ont fait leur apparition. Cependant, les difficultés de mise en œuvre du dépistage cytologique du cancer du col dans les milieux disposant de faibles ressources ont conduit à étudier la précision de tests de remplacement comme l’IVA et l’IVL, qui font appel à une technologie rudimentaire permettant cependant une détection précoce des néoplasies cervicales.
Les résultats de l’IVA et de l’IVL sont immédiatement disponibles, et ne nécessitent aucun service de laboratoire. La classification des résultats de l’IVA et de l’IVL repose sur les changements de couleur observés au niveau du col. Une parfaite connaissance de l’anatomie, de la physiologie et des pathologies du col, sont essentielles à la compréhension des principes de l’IVA et de l’IVL, et à l’interprétation des résultats obtenus par ces tests de dépistage. Cet ouvrage s’adresse aux dispensateurs de soins - médecins, infirmières, sages-femmes et personnel médical - désireux d’acquérir les connaissances et les compétences nécessaires à la pratique et au compte-rendu des résultats des tests IVA et IVL dont il décrit les principes et les applications.
Les résultats de l’IVA et de l’IVL sont immédiatement disponibles, et ne nécessitent aucun service de laboratoire. La classification des résultats de l’IVA et de l’IVL repose sur les changements de couleur observés au niveau du col. Une parfaite connaissance de l’anatomie, de la physiologie et des pathologies du col, sont essentielles à la compréhension des principes de l’IVA et de l’IVL, et à l’interprétation des résultats obtenus par ces tests de dépistage. Cet ouvrage s’adresse aux dispensateurs de soins - médecins, infirmières, sages-femmes et personnel médical - désireux d’acquérir les connaissances et les compétences nécessaires à la pratique et au compte-rendu des résultats des tests IVA et IVL dont il décrit les principes et les applications.
Anatomie générale du col utérin
Le col utérin correspond à la portion basse de l’utérus. De forme cylindrique ou conique, il mesure de 3 à 4 cm de long pour 2.5 cm à 3.5 cm de diamètre. Ses dimensions et sa forme varient en fonction de l’âge de la femme, de sa parité et de son statut hormonal. La moitié inférieure du col, désignée sous le nom de « portio vaginalis », s’avance dans le vagin par sa paroi antérieure, tandis que la moitié supérieure, appelée partie supra-vaginale, reste au-dessus du vagin (figure 1.1). Le col s’ouvre dans le vagin par l’orifice cervical externe. La partie supra-vaginale du col rencontre le corps musculaire de l’utérus au niveau de l’orifice cervical interne. Chez la femme multipare, le col est volumineux et l’orifice cervical externe apparaît sous la forme d’une large fente transversale béante. Chez la femme nullipare, l’orifice cervical externe se présente sous l’aspect d’une petite ouverture arrondie (trou d’épingle).
La portion du col s’étendant à l’extérieur de l’orifice externe est appelée exocol. C’est la partie aisément visible du col lors d’un examen au spéculum. La portion du col située au dessus de l’orifice externe (à l’intérieur) est appelée endocol. Le canal endocervical qui traverse le col, met en relation la cavité utérine avec le vagin. Il s’étend de l’orifice interne à l’orifice externe. Dans la partie supérieure de la cavité vaginale, l’espace entourant la portio vaginalis correspond à ce que l’on appelle le cul de sac vaginal.
Le stroma cervical est constitué d’un tissu fibromusculaire dense traversé par les réseaux vasculaires, lymphatiques et nerveux du col. Le réseau artériel du col est constitué par les branches cervicales et vaginales des artères utérines dérivées des artères iliaques internes. Sur une coupe sagittale du col, les branches cervicales des artères utérines descendent en position 3 et 9 heures. Les veines du col cheminent parallèlement aux artères pour se jeter dans le plexus veineux hypogastrique. Les vaisseaux lymphatiques du col se jettent dans les ganglions iliaques externe et interne, les ganglions obturateur et paramétrial. Le réseau nerveux du col est issu du plexus hypogastrique. L’endocol possède des terminaisons nerveuses sensitives étendues. En revanche, celles-ci sont peu nombreuses au niveau de l’exocol, si bien que le prélèvement de biopsies ou les traitements par cryothérapie sur l’exocol sont bien tolérés par la plupart des femmes sans anesthésie locale préalable. Il faut également signaler au niveau de l’endocol, l’abondance de fibres sympathiques et parasympathiques dont la stimulation au cours de certaines manipulations de l’endocol, peut parfois provoquer chez la patiente un malaise vagal avec parfois perte de connaissance brève.
La portion du col s’étendant à l’extérieur de l’orifice externe est appelée exocol. C’est la partie aisément visible du col lors d’un examen au spéculum. La portion du col située au dessus de l’orifice externe (à l’intérieur) est appelée endocol. Le canal endocervical qui traverse le col, met en relation la cavité utérine avec le vagin. Il s’étend de l’orifice interne à l’orifice externe. Dans la partie supérieure de la cavité vaginale, l’espace entourant la portio vaginalis correspond à ce que l’on appelle le cul de sac vaginal.
Le stroma cervical est constitué d’un tissu fibromusculaire dense traversé par les réseaux vasculaires, lymphatiques et nerveux du col. Le réseau artériel du col est constitué par les branches cervicales et vaginales des artères utérines dérivées des artères iliaques internes. Sur une coupe sagittale du col, les branches cervicales des artères utérines descendent en position 3 et 9 heures. Les veines du col cheminent parallèlement aux artères pour se jeter dans le plexus veineux hypogastrique. Les vaisseaux lymphatiques du col se jettent dans les ganglions iliaques externe et interne, les ganglions obturateur et paramétrial. Le réseau nerveux du col est issu du plexus hypogastrique. L’endocol possède des terminaisons nerveuses sensitives étendues. En revanche, celles-ci sont peu nombreuses au niveau de l’exocol, si bien que le prélèvement de biopsies ou les traitements par cryothérapie sur l’exocol sont bien tolérés par la plupart des femmes sans anesthésie locale préalable. Il faut également signaler au niveau de l’endocol, l’abondance de fibres sympathiques et parasympathiques dont la stimulation au cours de certaines manipulations de l’endocol, peut parfois provoquer chez la patiente un malaise vagal avec parfois perte de connaissance brève.

fig 1.1: Anatomie générale du col utérin
Anatomie microscopique
Epithélium pavimenteux
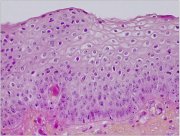
Le col est tapissé par deux types d’épithélium, un épithélium pavimenteux stratifié et un épithélium cylindrique qui se rencontrent à la jonction pavimento-cylindrique. Une grande partie de l’exocol est tapissée par un épithélium pavimenteux stratifié, non kératinisant, riche en glycogène. Opaque, il est constitué de plusieurs couches de cellules (15-20) (figure 1.2). A l’examen visuel, il apparaît de couleur rose pâle. Son architecture histologique révèle une couche inférieure constituée d’une assise unique de cellules basales rondes dotées d’un noyau important de couleur sombre à la coloration et d’un cytoplasme restreint. Cette couche inférieure est fixée à la membrane basale qui sépare l’épithélium du stroma sous-jacent. Les cellules basales se divisent et se différencient pour former les couches cellulaires parabasales intermédiaire et superficielle. En allant de la couche basale vers la couche superficielle, les cellules voient la taille de leur cytoplasme augmenter tandis que celle de leur noyau diminue. Sachant que l’iode réagit avec le glycogène que l’on trouve en abondance dans le cytoplasme des cellules des couches intermédiaire et superficielle, l’application du soluté de Lugol sur un épithélium pavimenteux entraîne sa coloration en noir ou en brun acajou. En revanche, après la ménopause, les cellules de l’épithélium pavimenteux ne subissent pas de maturation au-delà de la couche parabasale et ne s’amoncellent pas en couches successives de cellules superficielles et intermédiaires. Par conséquent, l’épithélium pavimenteux s’amincit et s’atrophie. Il apparaît alors pâle et sec, avec des pétéchies sub-épithéliales, car il est fragilisé et facilement blessé.
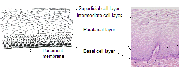
fig 1.2: Epithélium pavimenteux stratifié (x20)
Epithélium cylindrique
L’épithélium cylindrique (également désigné sous le nom d’épithélium glandulaire) tapisse le canal endocervical. Il est constitué d’une seule couche de cellules hautes aux noyaux de couleur sombre à la coloration (figure 1.3). A l’examen visuel, il apparaît plus ou moins papillaire et nettement rouge à cause de sa finesse (une seule couche cellulaire) qui laisse apparaître plus facilement la coloration du stroma sous-jacent. Il s’invagine dans le stroma cervical, provoquant la formation de cryptes endocervicales (également appelées glandes endocervicales). Les cellules de l’épithélium cylindrique sécrètent un mucus qui assure la lubrification du col et du vagin. Dans sa limite supérieure, il fusionne avec l’épithélium endométrial du corps utérin, et dans sa limite inférieure, il rencontre l’épithélium pavimenteux de l’exocol : c’est ce que l’on appelle la jonction pavimento-cylindrique. On observe parfois une prolifération localisée de l’épithélium cylindrique sous forme d’un polype : excroissance rougeâtre faisant saillie à partir de l’orifice externe (figure 2.2). L’épithélium cylindrique ne produit pas de glycogène, et ne change donc pas de couleur après l’application du soluté de Lugol, ou apparaît seulement légèrement décoloré sous un mince film de soluté iodé.
Jonction pavimento-cylindrique
La jonction pavimento-cylindrique (figure 1.4) se présente sous l’aspect d’une ligne étroite. Sa localisation par rapport à l’orifice externe varie en fonction de facteurs tels que l’âge, le statut hormonal, le traumatisme entraîné par l’accouchement et certaines conditions physiologiques comme la grossesse (figure 1.4). Durant l’enfance et la prépuberté, la jonction pavimento-cylindrique se situe au niveau - ou très proche - de l’orifice externe. Après la puberté et durant toute la période de reproduction, les organes génitaux féminins se développent sous l’influence des œstrogènes. Ainsi, le col s’élargit et le canal endocervical s’allonge. Il en résulte une éversion de l’épithélium cylindrique sur l’exocol, plus particulièrement sur les lèvres antérieure et postérieure du col. On désigne ce processus d’éversion sous les termes d’ectropion ou d’ectopie. La jonction pavimento-cylindrique se situe alors sur l’exocol, loin de l’orifice externe, pendant toute la période de reproduction et au cours de la grossesse (figure 1.4a). A l’examen visuel, l’ectropion se traduit par un exocol d’apparence très rouge (figure 1.4a).
L’action tampon du mucus tapissant les cellules cylindriques est contrariée quand l’éversion de l’épithélium cylindrique lors de l’ectropion l’expose à l’acidité du vagin. Ce phénomène entraîne la destruction et le remplacement de l’épithélium cylindrique par un épithélium pavimenteux métaplasique nouvellement formé. La métaplasie pavimenteuse désigne le remplacement d’un type d’épithélium par un autre. Quand la femme passe de la période reproductive à la périménopause, la localisation de la jonction pavimento-cylindrique commence progressivement à se rapprocher de l’orifice externe (figures 1.4b and c). Elle se situe donc à des distances variables de l’orifice externe, à cause de la formation progressive du nouvel épithélium pavimenteux métaplasique à partir des régions exposées de l’épithélium cylindrique sur l’exocol. Au cours de la périménopause et après le début de la ménopause, la diminution des taux d’œstrogènes entraîne une diminution de la taille du col et, par conséquent, un déplacement plus rapide de la jonction pavimento-cylindrique vers l’orifice externe et dans le canal endocervical (Figures 1.4c). Après la ménopause, la jonction pavimento-cylindrique se situe dans le canal endocervical, ce qui explique qu’elle soit souvent invisible à l’examen visuel (figure 1.4d).
L’action tampon du mucus tapissant les cellules cylindriques est contrariée quand l’éversion de l’épithélium cylindrique lors de l’ectropion l’expose à l’acidité du vagin. Ce phénomène entraîne la destruction et le remplacement de l’épithélium cylindrique par un épithélium pavimenteux métaplasique nouvellement formé. La métaplasie pavimenteuse désigne le remplacement d’un type d’épithélium par un autre. Quand la femme passe de la période reproductive à la périménopause, la localisation de la jonction pavimento-cylindrique commence progressivement à se rapprocher de l’orifice externe (figures 1.4b and c). Elle se situe donc à des distances variables de l’orifice externe, à cause de la formation progressive du nouvel épithélium pavimenteux métaplasique à partir des régions exposées de l’épithélium cylindrique sur l’exocol. Au cours de la périménopause et après le début de la ménopause, la diminution des taux d’œstrogènes entraîne une diminution de la taille du col et, par conséquent, un déplacement plus rapide de la jonction pavimento-cylindrique vers l’orifice externe et dans le canal endocervical (Figures 1.4c). Après la ménopause, la jonction pavimento-cylindrique se situe dans le canal endocervical, ce qui explique qu’elle soit souvent invisible à l’examen visuel (figure 1.4d).

fig 1.4: Localisation de la jonction pavimento-cylindrique (JPC)
Métaplasie pavimenteuse
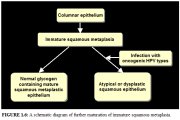
La métaplasie pavimenteuse débute dans les régions exposées de l’épithélium cylindrique par l’apparition de petites cellules rondes sub-cylindriques, appelées cellules de réserve, (figure 1.5a). C’est à partir de la prolifération (figure 1.5b) et de la différenciation de ces cellules de réserve, que se forme un épithélium multicellulaire mince, peu stratifié, appelé épithélium pavimenteux métaplasique immature (figure 1.5c). Les cellules de cet épithélium pavimenteux métaplasique immature ne produisent pas de glycogène, et par conséquent ne prennent pas la coloration brune ou noire lorsqu’elles sont exposées au soluté de Lugol. Plusieurs îlots de métaplasie pavimenteuse immature peuvent apparaître en même temps.
Le développement de l’épithélium métaplasique immature nouvellement formé peut se poursuivre selon une ou deux voies différentes (figure 1.6).Chez la grande majorité des femmes, il continue de se différencier pour constituer un épithélium métaplasique mature, bien stratifié, riche en glycogène, semblable en tous points à l’épithélium pavimenteux présent sur l’exocol (figure 1.5d). Dans ce cas, il prendra la coloration à l’iode lors de l’application du soluté de Lugol. Dans cet épithélium métaplasique mature, il est possible d’observer des kystes, appelés kystes de Naboth (figure 2.3). Il s’agit de kystes de rétention qui se développent à la suite de l’occlusion d’une ouverture de crypte endocervicale par l’épithélium pavimenteux métaplasique qui la recouvre. En effet, l’épithélium cylindrique resté enfermé dans la crypte continue parfois à sécréter du mucus qui finit par distendre les kystes. C’est ce mucus ainsi piégé qui donne au kyste une teinte blanc ivoire à l’examen visuel.
Chez une très petite minorité de femmes, la métaplasie pavimenteuse immature se poursuit parfois par le développement d’un épithélium dysplasique (épithélium anormal présentant des modifications cellulaires précancéreuses), suite à l’infection par certains types de virus du papillome humain (HPV) (figure 1.6).
Le développement de l’épithélium métaplasique immature nouvellement formé peut se poursuivre selon une ou deux voies différentes (figure 1.6).Chez la grande majorité des femmes, il continue de se différencier pour constituer un épithélium métaplasique mature, bien stratifié, riche en glycogène, semblable en tous points à l’épithélium pavimenteux présent sur l’exocol (figure 1.5d). Dans ce cas, il prendra la coloration à l’iode lors de l’application du soluté de Lugol. Dans cet épithélium métaplasique mature, il est possible d’observer des kystes, appelés kystes de Naboth (figure 2.3). Il s’agit de kystes de rétention qui se développent à la suite de l’occlusion d’une ouverture de crypte endocervicale par l’épithélium pavimenteux métaplasique qui la recouvre. En effet, l’épithélium cylindrique resté enfermé dans la crypte continue parfois à sécréter du mucus qui finit par distendre les kystes. C’est ce mucus ainsi piégé qui donne au kyste une teinte blanc ivoire à l’examen visuel.
Chez une très petite minorité de femmes, la métaplasie pavimenteuse immature se poursuit parfois par le développement d’un épithélium dysplasique (épithélium anormal présentant des modifications cellulaires précancéreuses), suite à l’infection par certains types de virus du papillome humain (HPV) (figure 1.6).
Zone de remaniement
La zone de remaniement correspond à la région du col où l’épithélium cylindrique a été ou est remplacé par l’épithélium métaplasique pavimenteux. Il est possible d’identifier à l’œil nu le bord interne de la zone de remaniement en suivant la jonction pavimento-cylindrique, et son bord externe en repérant les kystes de Naboth (s’il y en a) ou les orifices glandulaires (généralement visibles avec un grossissement) les plus éloignés. Avant la ménopause, la zone de remaniement est principalement située sur l’exocol. Après la ménopause, avec l’âge, les taux décroissants d’œstrogènes entraînant une diminution de la taille du col, il arrive que la zone de remaniement soit alors partiellement, et plus tard, totalement, déplacée dans le canal endocervical. Presque toutes les néoplasies cervicales débutent dans cette zone, à proximité de la jonction pavimento-cylindrique.
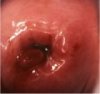
Inflammation du col de l’utérus (figure 1.7)
L’inflammation constitue la pathologie la plus fréquente affectant le col de l’utérus. Le plus souvent, elle est la conséquence d’une infection (généralement à germes multiples), mais de temps en temps, elle peut également être causée par la présence d’un corps étranger (tampon oublié, etc.), un traumatisme ou des irritants chimiques (gels et crèmes). Les agents infectieux les plus fréquemment mis en cause sont : Trichomonas vaginalis, Candida albicans ; la prolifération de bactéries anaérobies telles que Gardnerella vaginalis, G. mobilluncus et peptostreptococcus ; d’autres infections bactériennes à Haemophilus ducreyi, Neisseria gonorrhoeae, Chlamydia trachomatis, Escherichia coli, streptocoques, et staphylocoques ; et des infections virales, par exemple avec le virus de l’Herpès simplex.
L’épithélium cylindrique étant plus sensible aux infections que l’épithélium pavimenteux, nous emploierons dans cet ouvrage le terme de cervicite pour désigner l’ensemble des conditions inflammatoires cervico-vaginales. Au plan clinique, une cervicite peut se traduire par des pertes vaginales abondantes, des démangeaisons au niveau de la vulve et du vagin, une douleur et une sensation de brûlure lors des rapports sexuels, et des douleurs pelviennes. Les signes cliniques d’une cervicite col sont : des pertes abondantes colorées (grisâtre, blanc grisâtre, blanc crémeux (dans le cas d’une candidose), jaune ou jaune verdâtre), malodorantes ou inodores, d’aspect mousseux ou non, un col utérin sensible, rouge, présentant ou non des vésicules, des ulcérations et/ou une fibrose; l’épithélium cylindrique peut paraître aplati; et on peut parfois observer un érythème vulvaire accompagné d’un œdème, des traces d’écorchures sur la vulve, le vagin, l’intérieur des cuisses et le périnée. D’un point de vue microscopique, une cervicite se caractérise par la présence de débris cellulaires et d’abondantes sécrétions inflammatoires qui recouvrent la surface de l’épithélium. On observe également des cellules plus volumineuses et enflammées, une desquamation des cellules riches en glycogène des couches intermédiaires et superficielles, une mise à nu de l’épithélium, une ulcération superficielle ou profonde et une congestion du stroma cervical sous-jacent. Une inflammation chronique peut entraîner une ulcération récurrente à l’origine parfois d’une fibrose cicatricielle.
Il est possible d’établir un diagnostic de cervicite à partir des signes cliniques. A l’examen visuel, une cervicite due à une infection autre qu’une candidose peut se caractériser par un érythème et un œdème de la vulve, des traces d’écorchures sur la vulve et le vagin, un col sensible et rouge, des pertes mucopurulentes blanc grisâtre ou jaune verdâtre, malodorantes, la présence ou non d’ulcérations. Dans le cas d’une cervicite à gonocoques, la femme peut se plaindre également d’un écoulement urétral douloureux. Lors d’une candidose, la cervicite se caractérise généralement par un œdème et un érythème de la vulve, des traces d’écorchures, et des pertes inodores d’un blanc crémeux et d’une consistance épaisse. Lorsqu’il s’agit d’un herpès, on observe la présence de vésicules et d’ulcérations sur la région génitale externe, le vagin et le col qui devient très sensible. Les cervicites d’origine autre qu’une candidose, peuvent être traitées par l’administration simultanée par voie orale de 400 mg de métronidazole et 100 mg de doxycycline, deux fois par jour, pendant sept jours. S’il s’agit d’une cervicite à Candida, le traitement consistera en une application quotidienne intravaginale de 200 mg de clotrimazole ou miconazole, pendant trois jours.
L’épithélium cylindrique étant plus sensible aux infections que l’épithélium pavimenteux, nous emploierons dans cet ouvrage le terme de cervicite pour désigner l’ensemble des conditions inflammatoires cervico-vaginales. Au plan clinique, une cervicite peut se traduire par des pertes vaginales abondantes, des démangeaisons au niveau de la vulve et du vagin, une douleur et une sensation de brûlure lors des rapports sexuels, et des douleurs pelviennes. Les signes cliniques d’une cervicite col sont : des pertes abondantes colorées (grisâtre, blanc grisâtre, blanc crémeux (dans le cas d’une candidose), jaune ou jaune verdâtre), malodorantes ou inodores, d’aspect mousseux ou non, un col utérin sensible, rouge, présentant ou non des vésicules, des ulcérations et/ou une fibrose; l’épithélium cylindrique peut paraître aplati; et on peut parfois observer un érythème vulvaire accompagné d’un œdème, des traces d’écorchures sur la vulve, le vagin, l’intérieur des cuisses et le périnée. D’un point de vue microscopique, une cervicite se caractérise par la présence de débris cellulaires et d’abondantes sécrétions inflammatoires qui recouvrent la surface de l’épithélium. On observe également des cellules plus volumineuses et enflammées, une desquamation des cellules riches en glycogène des couches intermédiaires et superficielles, une mise à nu de l’épithélium, une ulcération superficielle ou profonde et une congestion du stroma cervical sous-jacent. Une inflammation chronique peut entraîner une ulcération récurrente à l’origine parfois d’une fibrose cicatricielle.
Il est possible d’établir un diagnostic de cervicite à partir des signes cliniques. A l’examen visuel, une cervicite due à une infection autre qu’une candidose peut se caractériser par un érythème et un œdème de la vulve, des traces d’écorchures sur la vulve et le vagin, un col sensible et rouge, des pertes mucopurulentes blanc grisâtre ou jaune verdâtre, malodorantes, la présence ou non d’ulcérations. Dans le cas d’une cervicite à gonocoques, la femme peut se plaindre également d’un écoulement urétral douloureux. Lors d’une candidose, la cervicite se caractérise généralement par un œdème et un érythème de la vulve, des traces d’écorchures, et des pertes inodores d’un blanc crémeux et d’une consistance épaisse. Lorsqu’il s’agit d’un herpès, on observe la présence de vésicules et d’ulcérations sur la région génitale externe, le vagin et le col qui devient très sensible. Les cervicites d’origine autre qu’une candidose, peuvent être traitées par l’administration simultanée par voie orale de 400 mg de métronidazole et 100 mg de doxycycline, deux fois par jour, pendant sept jours. S’il s’agit d’une cervicite à Candida, le traitement consistera en une application quotidienne intravaginale de 200 mg de clotrimazole ou miconazole, pendant trois jours.

fig 1.7: (a) Inflammation du col accompagnée d’une ulcération, de saignements, d’une nécrose, de pertes jaune verdâtre et d’un exsudat inflammatoire / (b) Col enflammé, très rouge, ayant perdu ses villosités au niveau de l’épithélium cylindrique, et recouvert d’un exsudat inflammatoire.
Néoplasies cervicales
Les cancers invasifs du col sont généralement précédés d’une longue période de la maladie à l’état préinvasif, caractérisée d’un point de vue microscopique par un spectre de lésions précurseurs allant de l’atypie cellulaire aux différents degrés de néoplasie cervicale intraépithéliale (CIN), avant d’évoluer vers un carcinome invasif. Des études épidémiologiques ont permis d’identifier un certain nombre de facteurs de risque qui contribuent au développement des CIN et du cancer du col : l’infection par certains types oncogènes de virus du papillome humain (HPV), la précocité des rapports sexuels, la multiplicité des partenaires sexuels, la multiparité, l’utilisation à long terme d’une contraception orale, le tabagisme, un statut socio-écomiquement faible, l’infection à Chlamydia trachomatis, les déficiences en micronutriments, et une alimentation pauvre en légumes et en fruits. Les types HPV 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 et 68 sont fortement associés aux CIN et au cancer invasif. On considère qu’une infection persistante avec l’un ou plusieurs d’entre eux est une cause nécessaire à l’apparition de la néoplasie cervicale.
Au cours d’une infection par un ou plusieurs types oncogènes de HPV, il peut y avoir intégration du génome viral au génome de la cellule hôte, entraînant ainsi la formation de cellules cervicales néoplasiques dont la prolifération est à l’origine des différents grades de CIN (synonymes : dysplasie ou lésions intraépithéliales épidermoïdes (LIE)) susceptibles d’évoluer par la suite vers un cancer invasif du col. Le Tableau 1 présente la corrélation entre la terminologie CIN utilisée dans cet ouvrage, et les autres terminologies existantes.
Au cours d’une infection par un ou plusieurs types oncogènes de HPV, il peut y avoir intégration du génome viral au génome de la cellule hôte, entraînant ainsi la formation de cellules cervicales néoplasiques dont la prolifération est à l’origine des différents grades de CIN (synonymes : dysplasie ou lésions intraépithéliales épidermoïdes (LIE)) susceptibles d’évoluer par la suite vers un cancer invasif du col. Le Tableau 1 présente la corrélation entre la terminologie CIN utilisée dans cet ouvrage, et les autres terminologies existantes.

table 1: Corrélation entre CIN, dysplasie et la terminologie Bethesda.
Néoplasie cervicale intraépithéliale
La présence d’une CIN ne se manifeste pas par des symptômes spécifiques ou des signes cliniques particuliers. Toutefois, il est possible de suspecter la présence d’une CIN quand, après l’application d’acide acétique à 3-5%, on repère à l’œil nu dans la zone de remaniement des zones acidophiles parfaitement délimitées, proches ou accolées à la jonction pavimento-cylindrique. De la même façon, on soupçonnera la présence d’une CIN, si après l’application du soluté de Lugol, on observe à l’œil nu dans la zone de remaniement, des régions bien délimitées iodo-négatives, jaune safran ou moutarde.
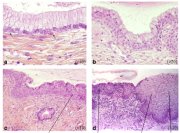
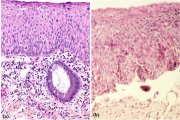
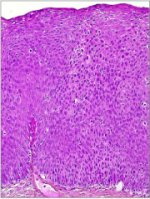
Cependant, seul l’examen histopathologique des échantillons de tissu cervical permet d’établir un diagnostic définitif de CIN. En effet, une CIN présente des cellules indifférenciées caractérisées par un noyau volumineux, une intensité accrue de la coloration nucléaire, un polymorphisme nucléaire avec une variation de la taille du noyau, et un cytoplasme restreint, ce qui se traduit par un rapport nucléo-cytoplasmique plus élevé. On détermine le grade de la CIN d’après la proportion de l’épaisseur de l’épithélium comportant des cellules indifférenciées. Ainsi, dans le cas d’une CIN 1, les cellules indifférenciées sont confinées aux couches les plus profondes de l’épithélium (tiers inférieur) (figure 1.8). On y observe des figures mitotiques, mais en très petit nombre. La CIN 2 se caractérise quant à elle par des modifications cellulaires dysplasiques confinées, pour la plupart, à la moitié inférieure ou aux deux tiers inférieurs de l’épithélium, avec des anomalies nucléaires plus marquées que pour la CIN 1 (figure 1.9). On peut également observer des figures mitotiques sur toute la moitié inférieure de l’épithélium. Dans le cas d’une CIN 3, la différenciation et la stratification sont parfois totalement absentes, ou uniquement présentes dans le quart supérieur de l’épithélium qui comporte de nombreuses figures mitotiques (Figure 1.10). On distingue des anomalies nucléaires sur toute l’épaisseur de l’épithélium, et de nombreuses figures mitotiques présentent des configurations anormales.
Il a été parfaitement démontré que la plupart des lésions de type CIN 1 sont passagères, c’est à dire qu’elles régressent vers la normale en relativement peu de temps, ou du moins, qu’elles n’évoluent pas vers des formes plus graves. En revanche, les CIN de haut grade (CIN 2-3), présentent une plus forte probabilité d’évolution vers un cancer invasif, même si une majorité d’entre elles régressent également ou persistent sans évoluer. Il semble qu’il s’écoule entre 10 et 20 ans avant que des lésions précurseurs du col ne progressent vers un cancer invasif.
Les CIN sont traitées par cryothérapie, électrorésection à l’anse diathermique (ERAD) ou conisation à froid. Lorsqu’on diagnostique une CIN 1, il est possible de conseiller à la patiente, soit un traitement immédiat (par exemple, dans des contextes où le suivi des femmes ne peut être assuré), soit un traitement ultérieur si la visite de contrôle, six à neuf mois plus tard, révèle une persistance ou une évolution de la maladie.
On appelle adénocarcinome in situ (AIS) une lésion précurseur qui se développe à partir de l’épithélium cylindrique. Ce dernier est alors remplacé par un épithélium anormal présentant des cellules anormales disposées de façon désordonnée, une augmentation de la taille des cellules et des noyaux, un hyperchromatisme nucléaire, une activité mitotique, une diminution de l’expression de la mucine cytoplasmique, ainsi qu’une stratification cellulaire.
Cependant, seul l’examen histopathologique des échantillons de tissu cervical permet d’établir un diagnostic définitif de CIN. En effet, une CIN présente des cellules indifférenciées caractérisées par un noyau volumineux, une intensité accrue de la coloration nucléaire, un polymorphisme nucléaire avec une variation de la taille du noyau, et un cytoplasme restreint, ce qui se traduit par un rapport nucléo-cytoplasmique plus élevé. On détermine le grade de la CIN d’après la proportion de l’épaisseur de l’épithélium comportant des cellules indifférenciées. Ainsi, dans le cas d’une CIN 1, les cellules indifférenciées sont confinées aux couches les plus profondes de l’épithélium (tiers inférieur) (figure 1.8). On y observe des figures mitotiques, mais en très petit nombre. La CIN 2 se caractérise quant à elle par des modifications cellulaires dysplasiques confinées, pour la plupart, à la moitié inférieure ou aux deux tiers inférieurs de l’épithélium, avec des anomalies nucléaires plus marquées que pour la CIN 1 (figure 1.9). On peut également observer des figures mitotiques sur toute la moitié inférieure de l’épithélium. Dans le cas d’une CIN 3, la différenciation et la stratification sont parfois totalement absentes, ou uniquement présentes dans le quart supérieur de l’épithélium qui comporte de nombreuses figures mitotiques (Figure 1.10). On distingue des anomalies nucléaires sur toute l’épaisseur de l’épithélium, et de nombreuses figures mitotiques présentent des configurations anormales.
Il a été parfaitement démontré que la plupart des lésions de type CIN 1 sont passagères, c’est à dire qu’elles régressent vers la normale en relativement peu de temps, ou du moins, qu’elles n’évoluent pas vers des formes plus graves. En revanche, les CIN de haut grade (CIN 2-3), présentent une plus forte probabilité d’évolution vers un cancer invasif, même si une majorité d’entre elles régressent également ou persistent sans évoluer. Il semble qu’il s’écoule entre 10 et 20 ans avant que des lésions précurseurs du col ne progressent vers un cancer invasif.
Les CIN sont traitées par cryothérapie, électrorésection à l’anse diathermique (ERAD) ou conisation à froid. Lorsqu’on diagnostique une CIN 1, il est possible de conseiller à la patiente, soit un traitement immédiat (par exemple, dans des contextes où le suivi des femmes ne peut être assuré), soit un traitement ultérieur si la visite de contrôle, six à neuf mois plus tard, révèle une persistance ou une évolution de la maladie.
On appelle adénocarcinome in situ (AIS) une lésion précurseur qui se développe à partir de l’épithélium cylindrique. Ce dernier est alors remplacé par un épithélium anormal présentant des cellules anormales disposées de façon désordonnée, une augmentation de la taille des cellules et des noyaux, un hyperchromatisme nucléaire, une activité mitotique, une diminution de l’expression de la mucine cytoplasmique, ainsi qu’une stratification cellulaire.
Cancer invasif
Dans les stades très précoces de l’invasion, le cancer du col peut ne manifester aucun symptôme ou signe cliniques évidents. On parle alors de cancer invasif infraclinique. Les femmes atteintes d’un cancer invasif du col à un stade modérément avancé ou avancé, se plaignent généralement d’un ou plusieurs des symptômes suivants : saignement intermenstruel, saignement post-coïtal, pertes vaginales abondantes séropurulentes, cystite récurrente, douleurs dorsales et pelviennes, œdème des membres inférieurs, obstruction urétérale, occlusion intestinale, dyspnée due à une forte anémie et à une cachexie.
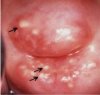
Comme l’invasion du stroma se poursuit, les signes cliniques de la maladie se manifestent, avec notamment, la présence de plusieurs tumeurs visibles lors de l’examen avec le spéculum. Des lésions débutantes peuvent se présenter sous forme de régions granuleuses, rougeâtres et rugueuses, saignant au toucher (figure 1.11). Les cancers plus avancés peuvent parfois se manifester par la présence d’une tumeur proliférative, protubérante, semblable à un champignon ou à un chou-fleur, des pertes vaginales nauséabondes et des saignements (figure 1.12). De temps en temps, ces cancers peuvent ne présenter aucune manifestation tumorale en surface, et se manifester seulement par une hypertrophie du col qui prend alors une forme irrégulière avec une surface granuleuse et rugueuse.
Lorsque l’invasion se poursuit, elle peut affecter le vagin, les paramètres, la paroi pelvienne, la vessie et le rectum. La compression de l’uretère provoquée par une tumeur localisée peut entraîner une obstruction urétérale responsable par la suite d’une hydronéphrose, et pour finir, d’une insuffisance rénale. L’invasion loco-régionale s’accompagne d’une extension métastatique aux ganglions régionaux. Les métastases dans les ganglions para-aortiques peuvent parfois traverser la capsule du ganglion pour aller directement envahir les vertèbres et les terminaisons nerveuses à l’origine de douleurs dorsales. Ainsi l’invasion directe des branches des terminaisons du nerf sciatique provoque des douleurs dorso-lombaires et des douleurs dans les membres inférieurs. De la même façon, l’atteinte des veines de la paroi pelvienne et du réseau lymphatique est parfois à l’origine d’un œdème des membres inférieurs. La dissémination des métastases à distance intervient de façon tardive au cours de la maladie. Ces métastases touchent généralement les ganglions para-aortiques, les poumons, le foie, les os, ainsi que d’autres organes.
D’un point de vue histologique, environ 90 à 95% des cancers invasifs du col dans les pays en développement sont des cancers épidermoïdes (figure 1.13), et seulement 2 à 8% correspondent à des adénocarcinomes (figure 1.14). Tous les cancers invasifs doivent être obligatoirement classifiés selon leur stade clinique. Le système de classification du cancer du col le plus utilisé est celui proposé par la Fédération Internationale de Gynécologie et d’Obstétrique (FIGO) (confère Annexe 1). C’est un système essentiellement basé sur une classification par stade en fonction de la taille de la tumeur et de l’étendue de la maladie à la région pelvienne. L’étendue du cancer est déterminée par les examens cliniques et autres analyses diverses, permettant de classer la maladie du stade I au stade IV. Le stade I représente une lésion localisée au col, tandis que le stade IV correspond à la phase tumorale avec métastases disséminées aux organes distants.
Une chirurgie radicale associée ou non à une radiothérapie permet de traiter des cancers invasifs débutants (stades I, II A). Les cancers de stades IIB et III devront être traités par radiothérapie combinée ou non avec une chimiothérapie au cysplatine. Les patientes atteintes de cancer de stade IV sont généralement traitées de façon palliative par radiothérapie et/ou chimiothérapie associée à des mesures thérapeutiques symptomatiques.
Comme l’invasion du stroma se poursuit, les signes cliniques de la maladie se manifestent, avec notamment, la présence de plusieurs tumeurs visibles lors de l’examen avec le spéculum. Des lésions débutantes peuvent se présenter sous forme de régions granuleuses, rougeâtres et rugueuses, saignant au toucher (figure 1.11). Les cancers plus avancés peuvent parfois se manifester par la présence d’une tumeur proliférative, protubérante, semblable à un champignon ou à un chou-fleur, des pertes vaginales nauséabondes et des saignements (figure 1.12). De temps en temps, ces cancers peuvent ne présenter aucune manifestation tumorale en surface, et se manifester seulement par une hypertrophie du col qui prend alors une forme irrégulière avec une surface granuleuse et rugueuse.
Lorsque l’invasion se poursuit, elle peut affecter le vagin, les paramètres, la paroi pelvienne, la vessie et le rectum. La compression de l’uretère provoquée par une tumeur localisée peut entraîner une obstruction urétérale responsable par la suite d’une hydronéphrose, et pour finir, d’une insuffisance rénale. L’invasion loco-régionale s’accompagne d’une extension métastatique aux ganglions régionaux. Les métastases dans les ganglions para-aortiques peuvent parfois traverser la capsule du ganglion pour aller directement envahir les vertèbres et les terminaisons nerveuses à l’origine de douleurs dorsales. Ainsi l’invasion directe des branches des terminaisons du nerf sciatique provoque des douleurs dorso-lombaires et des douleurs dans les membres inférieurs. De la même façon, l’atteinte des veines de la paroi pelvienne et du réseau lymphatique est parfois à l’origine d’un œdème des membres inférieurs. La dissémination des métastases à distance intervient de façon tardive au cours de la maladie. Ces métastases touchent généralement les ganglions para-aortiques, les poumons, le foie, les os, ainsi que d’autres organes.
D’un point de vue histologique, environ 90 à 95% des cancers invasifs du col dans les pays en développement sont des cancers épidermoïdes (figure 1.13), et seulement 2 à 8% correspondent à des adénocarcinomes (figure 1.14). Tous les cancers invasifs doivent être obligatoirement classifiés selon leur stade clinique. Le système de classification du cancer du col le plus utilisé est celui proposé par la Fédération Internationale de Gynécologie et d’Obstétrique (FIGO) (confère Annexe 1). C’est un système essentiellement basé sur une classification par stade en fonction de la taille de la tumeur et de l’étendue de la maladie à la région pelvienne. L’étendue du cancer est déterminée par les examens cliniques et autres analyses diverses, permettant de classer la maladie du stade I au stade IV. Le stade I représente une lésion localisée au col, tandis que le stade IV correspond à la phase tumorale avec métastases disséminées aux organes distants.
Une chirurgie radicale associée ou non à une radiothérapie permet de traiter des cancers invasifs débutants (stades I, II A). Les cancers de stades IIB et III devront être traités par radiothérapie combinée ou non avec une chimiothérapie au cysplatine. Les patientes atteintes de cancer de stade IV sont généralement traitées de façon palliative par radiothérapie et/ou chimiothérapie associée à des mesures thérapeutiques symptomatiques.

fig 1.11: Cancer invasif débutant du col: noter sa surface nodulaire, irrégulière, granuleuse, et saignant au toucher.

fig 1.12: Cancer invasif du col à un stade avancé: noter la tumeur ulcéroproliférative protubérante, semblable à un chou-fleur, les saignements et la nécrose.

fig 1.13: Histologie - Carcinome épidermoïde invasif kératinisant bien différencié (?10). Noter l’invasion du stroma par des groupes de cellules malignes.

fig 1.14: Histologie - Adénocarcinome invasif bien différencié. Noter les cellules malignes qui bordent les cryptes cervicales (x20)
Autres pathologies cervicales
La leucoplasie (hyperkératose) correspond à une zone blanche bien délimitée sur le col (avant l’application d’acide acétique) qui est visible à l’œil nu. La couleur blanche est due à la kératose. Habituellement, la leucoplasie est idiopathique, mais elle peut aussi être la conséquence d’une irritation chronique causée par un corps étranger, d’une infection à HPV, ou d’une néoplasie épidermoïde. Les condylomes, ou verrues génitales, correspondent souvent à un ensemble de multiples lésions exophytiques rarement observées sur le col, et plus fréquemment présentes sur le vagin et la vulve. Leur présence est liée à l’infection par certains types de HPV, notamment les types 6 et 11. Les condylomes peuvent aussi apparaître comme une lésion diffuse, d’un blanc grisâtre, affectant des régions du col et du vagin. Ils peuvent être visibles à l’œil nu (avant l’application d’acide acétique).
Principe physiopathologique de l’IVA
On pense que l’acide acétique à 5% provoque une coagulation ou une précipitation réversible des protéines cellulaires. Il provoque également un gonflement du tissu épithélial au niveau de l’épithélium cylindrique et des régions présentant notamment des anomalies de l’épithélium pavimenteux. Par ailleurs, il entraîne une déshydratation des cellules et facilite la coagulation et l’élimination du mucus sur le col. Avant l’application d’acide acétique, l’épithélium pavimenteux normal apparaît rose et l’épithélium cylindrique rouge, à cause de la réflexion de la lumière à partir du stroma sous-jacent richement vascularisé. Lorsqu’on applique l’acide acétique sur un épithélium contenant de fortes quantités de protéines cellulaires, la coagulation sera maximale et masquera la couleur rouge du stroma. Cette réaction acidophile se traduit par un blanchiment notable de l’épithélium comparé à la couleur rosâtre habituelle de l’épithélium cervical pavimenteux normal environnant. Cet effet, généralement visible à l’œil nu, dépend donc des taux de protéines cellulaires présents dans l’épithélium. Les modifications de coloration les plus spectaculaires s’observent dans les zones qui sont le siège d’une intense activité nucléaire et dont les taux d’ADN sont élevés.
Ainsi, quand on badigeonne d’acide acétique un épithélium pavimenteux normal, l’acide ne provoque qu’une légère coagulation dans la couche cellulaire superficielle, car l’activité nucléaire y est faible. Et bien qu’en profondeur, les cellules contiennent plus de protéines nucléaires, l’acide acétique ne peut y pénétrer suffisamment et la précipitation en résultant ne suffit pas à masquer la couleur rose du stroma sous-jacent. Au contraire, les CIN et les cancers invasifs présentent de fortes quantités de protéines nucléaires ( étant donné le grand nombre de cellules indifférenciées), si bien que la coagulation est maximale et empêche la lumière de passer à travers l’épithélium. Par conséquent, le réseau vasculaire sous-épithélial est masqué et l’épithélium apparaît nettement blanc. Dans le cas d’une CIN, la réaction acidophile est limitée à la zone de remaniement, près de la jonction pavimento-cylindrique, tandis que dans le cas d’un cancer, cette réaction affecte souvent la totalité du col.
L’apparition d’une réaction acidophile n’est pas uniquement réservée aux CIN et au cancer débutant. Il existe d’autres situations dans lesquelles les taux de protéines nucléaires sont élevés : métaplasie pavimenteuse immature, épithélium en cours de cicatrisation et de régénération (associé à une inflammation), leucoplasie (hyperkératose) et condylome. Alors que l’épithélium acidophile associé à une CIN et au cancer invasif infraclinique, apparaît dense, épais et opaque, avec des marges bien délimitées par rapport à l’épithélium normal environnant, l’épithélium acidophile associé à une métaplasie immature, une inflammation, ou une régénération, apparaît moins blanc, opalescent, plus mince et souvent translucide, aux contours mal définis, avec une distribution inégale. En présence d’une inflammation ou d’une cicatrisation, la réaction acidophile est largement répandue sur tout le col et ne se limite pas à la zone de remaniement. D’autre part, l’effet de l’acide acétique se dissipe rapidement dans le cas de la métaplasie immature et de l’inflammation (en moins d’une minute), tandis que les modifications acidophiles associées aux lésions de CIN et aux stades précoces du cancer invasif infraclinique, apparaissent rapidement et persistent quelques minutes - entre 3 et 5 minutes dans le cas des CIN de haut grade (2 et 3) et du cancer invasif. Sous l’effet de l’acide acétique, la leucoplasie et le condylome se manifestent par l’apparition d’une zone blanc grisâtre bien nette.
Ainsi, quand on badigeonne d’acide acétique un épithélium pavimenteux normal, l’acide ne provoque qu’une légère coagulation dans la couche cellulaire superficielle, car l’activité nucléaire y est faible. Et bien qu’en profondeur, les cellules contiennent plus de protéines nucléaires, l’acide acétique ne peut y pénétrer suffisamment et la précipitation en résultant ne suffit pas à masquer la couleur rose du stroma sous-jacent. Au contraire, les CIN et les cancers invasifs présentent de fortes quantités de protéines nucléaires ( étant donné le grand nombre de cellules indifférenciées), si bien que la coagulation est maximale et empêche la lumière de passer à travers l’épithélium. Par conséquent, le réseau vasculaire sous-épithélial est masqué et l’épithélium apparaît nettement blanc. Dans le cas d’une CIN, la réaction acidophile est limitée à la zone de remaniement, près de la jonction pavimento-cylindrique, tandis que dans le cas d’un cancer, cette réaction affecte souvent la totalité du col.
L’apparition d’une réaction acidophile n’est pas uniquement réservée aux CIN et au cancer débutant. Il existe d’autres situations dans lesquelles les taux de protéines nucléaires sont élevés : métaplasie pavimenteuse immature, épithélium en cours de cicatrisation et de régénération (associé à une inflammation), leucoplasie (hyperkératose) et condylome. Alors que l’épithélium acidophile associé à une CIN et au cancer invasif infraclinique, apparaît dense, épais et opaque, avec des marges bien délimitées par rapport à l’épithélium normal environnant, l’épithélium acidophile associé à une métaplasie immature, une inflammation, ou une régénération, apparaît moins blanc, opalescent, plus mince et souvent translucide, aux contours mal définis, avec une distribution inégale. En présence d’une inflammation ou d’une cicatrisation, la réaction acidophile est largement répandue sur tout le col et ne se limite pas à la zone de remaniement. D’autre part, l’effet de l’acide acétique se dissipe rapidement dans le cas de la métaplasie immature et de l’inflammation (en moins d’une minute), tandis que les modifications acidophiles associées aux lésions de CIN et aux stades précoces du cancer invasif infraclinique, apparaissent rapidement et persistent quelques minutes - entre 3 et 5 minutes dans le cas des CIN de haut grade (2 et 3) et du cancer invasif. Sous l’effet de l’acide acétique, la leucoplasie et le condylome se manifestent par l’apparition d’une zone blanc grisâtre bien nette.
Principe physiopathologique de l’IVL
L’épithélium métaplasique pavimenteux est riche en glycogène, tandis que les lésions de CIN ou le cancer invasif ne contiennent pas de glycogène ou très peu. L’épithélium cylindrique, lui aussi, ne contient pas de glycogène, de même que l’épithélium pavimenteux métaplasique immature qui n’est que rarement partiellement glycogéné. L’iode étant glycophile, une solution iodée sera donc absorbée par un épithélium riche en glycogène. Raison pour laquelle, l’épithélium pavimenteux normal riche en glycogène prend une coloration noire ou acajou après application d’iode. En revanche, l’épithélium cylindrique qui ne contient pas de glycogène, ne prend pas la coloration à l’iode, et peut même paraître légèrement décoloré à cause de la fine pellicule déposée par la solution iodée. De la même façon, les zones tapissées par un épithélium pavimenteux métaplasique immature restent iodo-négatives ou ne prennent que partiellement la coloration à l’iode. En cas d’érosion des couches cellulaires superficielles et intermédiaires associée à une inflammation de l’épithélium pavimenteux, ces zones ne prennent pas la coloration à l’iode et apparaissent nettement décolorées sur un fond brun ou noir. Les zones affectées par une CIN ou un cancer invasif sont également iodo-négatives (puisqu’elles sont déficientes en glycogène) et apparaissent sous l’aspect de régions jaune moutarde ou safran, épaisses. Les zones leucoplasiques (hyperkératose) sont elles aussi iodo-négatives. Quant aux condylomes, ils peuvent occasionnellement prendre la coloration à l’iode de façon partielle.