Accueil / Formation / Manuels / Colposcopie et Traitement des Néoplasies Cervicales Intraépithéliales / Chapitre 3 : Introduction au cancer invasif du col de l’utérus
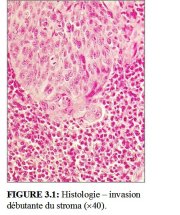 figure 3.1: Histologie – invasion ...
figure 3.1: Histologie – invasion ...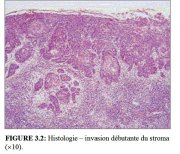 figure 3.2: Histologie – invasion ...
figure 3.2: Histologie – invasion ...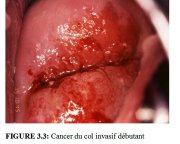 figure 3.3: Cancer du col invasif ...
figure 3.3: Cancer du col invasif ...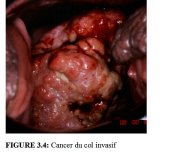 figure 3.4: Cancer du col invasif
...
figure 3.4: Cancer du col invasif
...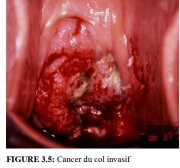 figure 3.5: Cancer du col invasif
...
figure 3.5: Cancer du col invasif
...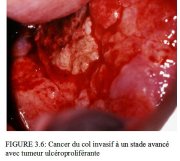 figure 3.6: Cancer du col invasif ...
figure 3.6: Cancer du col invasif ...
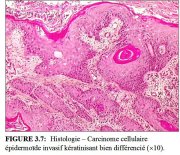 figure3.7: Histologie – Carcinome ...
figure3.7: Histologie – Carcinome ...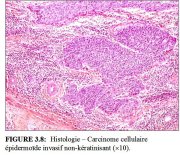 figure 3.8: Histologie – Carcinome...
figure 3.8: Histologie – Carcinome...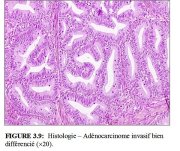 figure 3.9: Histologie – Adénocarc...
figure 3.9: Histologie – Adénocarc...
 table 3.1: Système de classificati...
table 3.1: Système de classificati...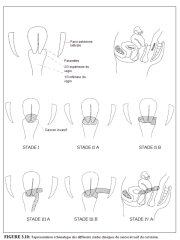 figure 3.10: Représentation schéma...
figure 3.10: Représentation schéma...
Colposcopie et Traitement des Néoplasies Cervicales Intraépithéliales : Manuel à l'usage des débutants, édité par J.W. Sellors et R. Sankaranarayanan
Chapitre 3 : Introduction au cancer invasif du col de l’utérus
Autre langue: English / Français / Español / Portugues / ">中文- Le cancer invasif infraclinique désigne un cancer du col dans sa phase précoce qui commence juste à pénétrer le stroma cervical sous-jacent et qui, bien souvent, ne se manifeste par aucun symptôme ou caractéristique clinique évident.
- Lorsque l’invasion atteint le stroma, la maladie se manifeste cliniquement par l’apparition de plusieurs tumeurs visibles à l’examen avec le spéculum.
- D’un point de vue histologique, 90 à 95% des cancers invasifs du col sont des cancers épidermoïdes. L’adénocarcinome représente moins de 5% des cancers du col dans la plupart des pays en développement.
- Le système de classification par stade le plus utilisé pour le cancer invasif du col, s’appuie sur la taille de la tumeur et la propagation de la maladie au vagin, à la paroi pelvienne, aux paramètres, à la vessie, au rectum et aux organes éloignés.
- Le stade clinique de la maladie au moment de sa détection constitue le seul critère important de prédiction en terme de survie pour le cancer invasif du col.
Ce chapitre traite des aspects cliniques et du diagnostic du carcinome invasif du col. Lors d’un toucher vaginal ou d’un examen à l’aide du spéculum, la présence d’anomalies physiques peut suggérer la présence d’un cancer invasif du col. On confirmera ce diagnostic par l’examen histologique des échantillons de tissu. Dans une certaine proportion de ces cancers, il n’existe aucun symptôme ou anomalie manifestes lors de l’examen médical. Il s’agit alors de cancers du col invasifs infracliniques. Et c’est à ce stade que la colposcopie a un rôle important à jouer en tant qu’outil diagnostique des cancers invasifs débutants infracliniques.
Caractéristiques cliniques
Les femmes atteintes d’un cancer du col souffrent souvent d’un ou plusieurs symptômes parmi les suivants : saignement intermenstruel, saignement post-coïtal, saignements menstruels plus abondants, pertes vaginales séropurulentes excessives, pertes nauséabondes, cystite récurrente, fréquentes et urgentes envies d’uriner, douleurs dorsales et pelviennes. Dans les stades avancés de la maladie, les patientes peuvent présenter une dysphnée dûe à l’anémie, une obstruction urétérale, un œdème des membres inférieurs, une hématurie, une occlusion intestinale et une cachexie. Chez la plupart de ces patientes, l’examen du vagin au spéculum révèle une tumeur ulcéroproliférative.
Dans les stades très précoces de l’invasion du stroma, le cancer du col peut ne manifester aucun symptôme ou aspect clinique évidents. On parle alors de maladie invasive infraclinique. La forme la plus précoce du cancer invasif est histologiquement identifiée comme un carcinome microinvasif : cancer dont la pénétration dans le stroma cervical sous-jacent ne dépasse pas 5 mm de profondeur et 7 mm de largeur. Ces cancers microinvasifs ont l’aspect d’un minuscule bourgeon de cellules invasives qui ont traversé la membrane basale pour pénétrer dans le stroma sous-jacent (Figures 3.1 et 3.2). La réaction du stroma à l’invasion peut également se traduire par le rassemblement localisé de lymphocytes et parfois même, par la disparition du stroma autour de la zone envahie.
Comme l’invasion du stroma se poursuit, les symptômes cliniques de la maladie se manifestent, avec notamment la présence de plusieurs tumeurs souvent visibles à l’examen avec le spéculum. Des lésions débutantes peuvent se présenter sous forme de zones granuleuses, rougeâtres et rugueuses, qui saignent au toucher (Figure 3.3). Les cancers plus avancés sont soit exophytiques, soit endophytiques, soit une combinaison des deux (Figures 3.4-3.6). Les cancers exophytiques sont généralement invasifs de façon superficielle et leur masse croit dans la lumière vaginale comme un champignon ou comme un chou-fleur, avec des excroissances polypoïdes ou papillaires. En revanche, les cancers endophytiques sont susceptibles d’infiltrer largement le stroma et de déformer le col, sans pour autant se manifester de façon visible en surface. Tant qu’elles restent d’un diamètre inférieur à 5-6 cm, de telles lésions peuvent s’étendre dans l’endocol sans affecter l’épithélium pavimenteux cervical qui reste intact. Elles finissent par entraîner une nette hypertrophie du col qui prend une forme en barillet, avec une surface rugueuse, granuleuse ou papillaire. De tels cancers peuvent rester longtemps silencieux. Certaines tumeurs exophytiques et endophytiques ont un aspect ulcéreux et s’infiltrent profondément dans le stroma sous-jacent. Dans les deux cas, le saignement au toucher et la nécrose constituent les caractéristiques cliniques prédominantes. Les pertes vaginales nauséabondes fréquemment constatées sont provoquées par une surinfection anaérobie du tissu nécrosé.
Lorsque l’invasion se poursuit, elle peut affecter le vagin, les paramètres, la paroi pelvienne, la vessie et le rectum. La compression de l’uretère provoquée par une tumeur localisée peut entraîner une obstruction urétérale responsable par la suite d’une hydronéphrose (dilatation rénale) et pour finir d’une insuffisance rénale. L’invasion loco-régionale s’accompagne d’une extension métastatique aux ganglions régionaux. Les métastases dans les ganglions para-aortiques peuvent traverser la capsule du ganglion pour aller directement envahir les vertèbres et les terminaisons nerveuses. Ainsi, l’invasion des branches du nerf sciatique est à l’origine des douleurs dorso-lombaires. De même, l’atteinte des veines de la paroi pelvienne et du réseau lymphatique provoque un œdème des membres inférieurs. Il peut y avoir dissémination des métastases par voie sanguine aux vertèbres lombaires et au muscle psoas sans que la maladie ne se soit manifestée par des excroissances. Les métastases à distance qui se produisent plus tardivement, touchent généralement les ganglions para-aortiques, les poumons, le foie, les os, ainsi que d’autres organes.
Dans les stades très précoces de l’invasion du stroma, le cancer du col peut ne manifester aucun symptôme ou aspect clinique évidents. On parle alors de maladie invasive infraclinique. La forme la plus précoce du cancer invasif est histologiquement identifiée comme un carcinome microinvasif : cancer dont la pénétration dans le stroma cervical sous-jacent ne dépasse pas 5 mm de profondeur et 7 mm de largeur. Ces cancers microinvasifs ont l’aspect d’un minuscule bourgeon de cellules invasives qui ont traversé la membrane basale pour pénétrer dans le stroma sous-jacent (Figures 3.1 et 3.2). La réaction du stroma à l’invasion peut également se traduire par le rassemblement localisé de lymphocytes et parfois même, par la disparition du stroma autour de la zone envahie.
Comme l’invasion du stroma se poursuit, les symptômes cliniques de la maladie se manifestent, avec notamment la présence de plusieurs tumeurs souvent visibles à l’examen avec le spéculum. Des lésions débutantes peuvent se présenter sous forme de zones granuleuses, rougeâtres et rugueuses, qui saignent au toucher (Figure 3.3). Les cancers plus avancés sont soit exophytiques, soit endophytiques, soit une combinaison des deux (Figures 3.4-3.6). Les cancers exophytiques sont généralement invasifs de façon superficielle et leur masse croit dans la lumière vaginale comme un champignon ou comme un chou-fleur, avec des excroissances polypoïdes ou papillaires. En revanche, les cancers endophytiques sont susceptibles d’infiltrer largement le stroma et de déformer le col, sans pour autant se manifester de façon visible en surface. Tant qu’elles restent d’un diamètre inférieur à 5-6 cm, de telles lésions peuvent s’étendre dans l’endocol sans affecter l’épithélium pavimenteux cervical qui reste intact. Elles finissent par entraîner une nette hypertrophie du col qui prend une forme en barillet, avec une surface rugueuse, granuleuse ou papillaire. De tels cancers peuvent rester longtemps silencieux. Certaines tumeurs exophytiques et endophytiques ont un aspect ulcéreux et s’infiltrent profondément dans le stroma sous-jacent. Dans les deux cas, le saignement au toucher et la nécrose constituent les caractéristiques cliniques prédominantes. Les pertes vaginales nauséabondes fréquemment constatées sont provoquées par une surinfection anaérobie du tissu nécrosé.
Lorsque l’invasion se poursuit, elle peut affecter le vagin, les paramètres, la paroi pelvienne, la vessie et le rectum. La compression de l’uretère provoquée par une tumeur localisée peut entraîner une obstruction urétérale responsable par la suite d’une hydronéphrose (dilatation rénale) et pour finir d’une insuffisance rénale. L’invasion loco-régionale s’accompagne d’une extension métastatique aux ganglions régionaux. Les métastases dans les ganglions para-aortiques peuvent traverser la capsule du ganglion pour aller directement envahir les vertèbres et les terminaisons nerveuses. Ainsi, l’invasion des branches du nerf sciatique est à l’origine des douleurs dorso-lombaires. De même, l’atteinte des veines de la paroi pelvienne et du réseau lymphatique provoque un œdème des membres inférieurs. Il peut y avoir dissémination des métastases par voie sanguine aux vertèbres lombaires et au muscle psoas sans que la maladie ne se soit manifestée par des excroissances. Les métastases à distance qui se produisent plus tardivement, touchent généralement les ganglions para-aortiques, les poumons, le foie, les os, ainsi que d’autres organes.
 figure 3.1: Histologie – invasion ...
figure 3.1: Histologie – invasion ... figure 3.2: Histologie – invasion ...
figure 3.2: Histologie – invasion ... figure 3.3: Cancer du col invasif ...
figure 3.3: Cancer du col invasif ... figure 3.4: Cancer du col invasif
...
figure 3.4: Cancer du col invasif
... figure 3.5: Cancer du col invasif
...
figure 3.5: Cancer du col invasif
... figure 3.6: Cancer du col invasif ...
figure 3.6: Cancer du col invasif ...Pathologie microscopique
D’un point de vue histologique, environ 90 à 95% des cancers invasifs du col dans les pays en développement sont des cancers épidermoïdes (Figures 3.7 et 3.8), et seulement 2 à 8% sont des adénocarcinomes (Figure 3.9).
A l’examen microscopique, on distingue dans la plupart des carcinomes cellulaires épidermoïdes des groupements de cellules néoplasiques envahissant le stroma. Ces carcinomes présentent une grande diversité tant du point de vue des caractéristiques tumorales, des types cellulaires et du degré de différenciation. Les lymphocytes et les cellules plasmatiques infiltrent le stroma cervical séparant les groupes de cellules malignes. Ces dernières sont classées en deux catégories : kératinisantes et non-kératinisantes. Les tumeurs peuvent correspondre à des carcinomes bien différenciés, modérément ou faiblement différenciés. Environ 50 à 60% des cancers du col sont des carcinomes modérément différenciés, le reste se partage de façon équilibrée entre carcinomes faiblement et bien différenciés.
Le carcinome épidermoïde kératinisant est constitué de volutes caractéristiques de cellules épidermoïdes contenant des nids centraux de kératine (perles de kératine) (Figure 3.7). Leurs noyaux sont volumineux et hyperchromatiques, avec une chromatine sous forme de grains. On distingue des ponts intercellulaires, ainsi que des granules de kératohyaline et une kératinisation cytoplasmique. Il y a peu de figures mitotiques visibles.
Le carcinome épidermoïde non-kératinisant (Figure 3.8) est constitué de nids irréguliers (bords déchiquetés) de cellules polygonales arrondies qui infiltrent le stroma cervical. Il peut y avoir une dyskératose et des ponts intercellulaires. Les polymorphismes cellulaires et nucléaires sont plus évidents et les figures mitotiques assez nombreuses. Il n’y a généralement pas de perles de kératine.
Il existe d’autres types de carcinomes épidermoïdes peu fréquents comme le carcinome épidermoïde condylomateux (également appelé carcinome verruqueux), le carcinome épidermoïde papillaire, le carcinome de type lymphoépithéliome, et le carcinome épidermoïde transitionnel.
Dans de nombreux pays en développement, l’adénocarcinome représente moins de 5% de la totalité des cancers du col. Le plus souvent, il débute à partir de l’épithélium glandulaire au niveau du canal endocervical. L’adénocarcinome de type endocervical est la forme la plus fréquente. On observe alors des glandes anormales de forme et de taille variées avec des bourgeonnements et des ramifications (Figure 3.9). La plupart de ces tumeurs sont modérément à bien différenciées. Les éléments glandulaires sont agencés en un motif complexe. Il peut y avoir des projections papillaires dans la lumière glandulaire et en surface. Quelques-unes des cellules contiennent parfois une quantité modérée ou importante de mucine.
Il existe d’autres types d’adénocarcinomes : adénocarcinome de type intestinal, adénocarcinome de type cellules en bague à chaton, adénocarcinome malignum, adénocarcinome papillaire villoglandulaire, adénocarcinome endométrioïde et adénocarcinome papillaire séreux. L’adénocarcinome adénoépidermoïde correspond à des tumeurs qui ont à la fois un aspect épidermoïde et glandulaire.
Qu’il s’agisse d’un carcinome épidermoïde ou d’un adénocarcinome du col, la présence de cellules tumorales dans la lumière d’un capillaire lymphatique reflète un potentiel tumoral agressif. Elle est en effet corrélée à un risque accru de métastases dans les ganglions régionaux. Plus grave encore est l’invasion des vaisseaux sanguins. C’est un mauvais signe pronostique car elle est corrélée avec le risque de métastases à distance par voie sanguine. Bien que les caractéristiques cytologiques associées au cancer épidermoïde du col aient été parfaitement décrites, la cytologie ne constitue pas une méthode fiable de diagnostic des lésions invasives. L’identification de ces lésions sur des frottis cytologiques nécessite beaucoup d’expérience, car un frottis du col contient souvent très peu de cellules malignes noyées dans un assortiment de débris et d’hématies. Bien souvent, les cytologistes ne peuvent pas reconnaître un adénocarcinome du col. Seul un cytologiste confirmé sera capable d’identifier un adénocarcinome, à condition que celui-ci présente des caractéristiques cellulaires complètement différentes du tissu normal. L’identification des types cellulaires individuels est encore plus difficile. Par conséquent, dans tous les cas, seule l’histopathologie permettra de confirmer le diagnostic final d’un cancer invasif. Il est préférable d’établir le diagnostic à partir d’un échantillon de tissu prélevé à la périphérie de la tumeur, car on a ainsi plus de chance d’obtenir du tissu tumoral morphologiquement intact, tandis qu’une biopsie prélevée en plein centre de la tumeur, contient parfois du matériel nécrosé qui peut compromettre la précision du diagnostic histologique.
A l’examen microscopique, on distingue dans la plupart des carcinomes cellulaires épidermoïdes des groupements de cellules néoplasiques envahissant le stroma. Ces carcinomes présentent une grande diversité tant du point de vue des caractéristiques tumorales, des types cellulaires et du degré de différenciation. Les lymphocytes et les cellules plasmatiques infiltrent le stroma cervical séparant les groupes de cellules malignes. Ces dernières sont classées en deux catégories : kératinisantes et non-kératinisantes. Les tumeurs peuvent correspondre à des carcinomes bien différenciés, modérément ou faiblement différenciés. Environ 50 à 60% des cancers du col sont des carcinomes modérément différenciés, le reste se partage de façon équilibrée entre carcinomes faiblement et bien différenciés.
Le carcinome épidermoïde kératinisant est constitué de volutes caractéristiques de cellules épidermoïdes contenant des nids centraux de kératine (perles de kératine) (Figure 3.7). Leurs noyaux sont volumineux et hyperchromatiques, avec une chromatine sous forme de grains. On distingue des ponts intercellulaires, ainsi que des granules de kératohyaline et une kératinisation cytoplasmique. Il y a peu de figures mitotiques visibles.
Le carcinome épidermoïde non-kératinisant (Figure 3.8) est constitué de nids irréguliers (bords déchiquetés) de cellules polygonales arrondies qui infiltrent le stroma cervical. Il peut y avoir une dyskératose et des ponts intercellulaires. Les polymorphismes cellulaires et nucléaires sont plus évidents et les figures mitotiques assez nombreuses. Il n’y a généralement pas de perles de kératine.
Il existe d’autres types de carcinomes épidermoïdes peu fréquents comme le carcinome épidermoïde condylomateux (également appelé carcinome verruqueux), le carcinome épidermoïde papillaire, le carcinome de type lymphoépithéliome, et le carcinome épidermoïde transitionnel.
Dans de nombreux pays en développement, l’adénocarcinome représente moins de 5% de la totalité des cancers du col. Le plus souvent, il débute à partir de l’épithélium glandulaire au niveau du canal endocervical. L’adénocarcinome de type endocervical est la forme la plus fréquente. On observe alors des glandes anormales de forme et de taille variées avec des bourgeonnements et des ramifications (Figure 3.9). La plupart de ces tumeurs sont modérément à bien différenciées. Les éléments glandulaires sont agencés en un motif complexe. Il peut y avoir des projections papillaires dans la lumière glandulaire et en surface. Quelques-unes des cellules contiennent parfois une quantité modérée ou importante de mucine.
Il existe d’autres types d’adénocarcinomes : adénocarcinome de type intestinal, adénocarcinome de type cellules en bague à chaton, adénocarcinome malignum, adénocarcinome papillaire villoglandulaire, adénocarcinome endométrioïde et adénocarcinome papillaire séreux. L’adénocarcinome adénoépidermoïde correspond à des tumeurs qui ont à la fois un aspect épidermoïde et glandulaire.
Qu’il s’agisse d’un carcinome épidermoïde ou d’un adénocarcinome du col, la présence de cellules tumorales dans la lumière d’un capillaire lymphatique reflète un potentiel tumoral agressif. Elle est en effet corrélée à un risque accru de métastases dans les ganglions régionaux. Plus grave encore est l’invasion des vaisseaux sanguins. C’est un mauvais signe pronostique car elle est corrélée avec le risque de métastases à distance par voie sanguine. Bien que les caractéristiques cytologiques associées au cancer épidermoïde du col aient été parfaitement décrites, la cytologie ne constitue pas une méthode fiable de diagnostic des lésions invasives. L’identification de ces lésions sur des frottis cytologiques nécessite beaucoup d’expérience, car un frottis du col contient souvent très peu de cellules malignes noyées dans un assortiment de débris et d’hématies. Bien souvent, les cytologistes ne peuvent pas reconnaître un adénocarcinome du col. Seul un cytologiste confirmé sera capable d’identifier un adénocarcinome, à condition que celui-ci présente des caractéristiques cellulaires complètement différentes du tissu normal. L’identification des types cellulaires individuels est encore plus difficile. Par conséquent, dans tous les cas, seule l’histopathologie permettra de confirmer le diagnostic final d’un cancer invasif. Il est préférable d’établir le diagnostic à partir d’un échantillon de tissu prélevé à la périphérie de la tumeur, car on a ainsi plus de chance d’obtenir du tissu tumoral morphologiquement intact, tandis qu’une biopsie prélevée en plein centre de la tumeur, contient parfois du matériel nécrosé qui peut compromettre la précision du diagnostic histologique.
 figure3.7: Histologie – Carcinome ...
figure3.7: Histologie – Carcinome ... figure 3.8: Histologie – Carcinome...
figure 3.8: Histologie – Carcinome... figure 3.9: Histologie – Adénocarc...
figure 3.9: Histologie – Adénocarc...Classification
La planification du traitement et l’établissement du pronostic nécessitent une évaluation précise de l’état de santé général de la patiente et l’identification du stade clinique du cancer invasif. Le système de classification du cancer du col le plus utilisé est celui proposé par la Fédération Internationale de Gynécologie et d’Obstétrique (FIGO). Il est présenté dans le Tableau 3.1. C’est un système essentiellement basé sur une classification par stades en fonction de la taille de la tumeur et de l’étendue de la maladie au pelvis. L’étendue du cancer est déterminée par les examens cliniques et autres analyses diverses permettant de classer la maladie du stade I au stade IV (Tableau 3.1 et Figure 3.10). Le stade I représente une lésion localisée au col, tandis que le stade IV correspond à la phase tumorale avec métastases disséminées aux organes distants.
On établit le stade de la maladie selon la classification FIGO grâce à : l’inspection, le toucher recto-vaginal, la colposcopie, la cystoscopie, le curetage endocervical, l’hystéroscopie, l’urographie intraveineuse, la radio du thorax et du squelette. La lymphangiographie, l’échographie, la tomographie computerisée (CT-scan), l’imagerie par résonance magnétique (IRM) et la laparoscopie peuvent également fournir quelques indications supplémentaires, mais ne peuvent être utilisées pour établir les stades cliniques FIGO, même si les renseignements qu’elles procurent présentent un réel intérêt pour la planification d’un traitement. Cependant, dans de nombreux milieux disposant de faibles ressources, l’examen au spéculum associé au toucher recto-vaginal réprésente souvent la seule approche possible pour établir le stade de la maladie. Quand c’est possible, on pourra apporter confirmation par cystoscopie et radiologie (radio du thorax et du squelette, urographie intraveineuse). Dès qu’un cancer invasif du col est décelé, il faut systématiquement procéder à sa classification et enregistrer celle-ci dans le dossier de la patiente sous forme d’un diagramme descriptif. Les examens et les méthodes ayant permis cette classification devront également être précisés.
On établit le stade de la maladie selon la classification FIGO grâce à : l’inspection, le toucher recto-vaginal, la colposcopie, la cystoscopie, le curetage endocervical, l’hystéroscopie, l’urographie intraveineuse, la radio du thorax et du squelette. La lymphangiographie, l’échographie, la tomographie computerisée (CT-scan), l’imagerie par résonance magnétique (IRM) et la laparoscopie peuvent également fournir quelques indications supplémentaires, mais ne peuvent être utilisées pour établir les stades cliniques FIGO, même si les renseignements qu’elles procurent présentent un réel intérêt pour la planification d’un traitement. Cependant, dans de nombreux milieux disposant de faibles ressources, l’examen au spéculum associé au toucher recto-vaginal réprésente souvent la seule approche possible pour établir le stade de la maladie. Quand c’est possible, on pourra apporter confirmation par cystoscopie et radiologie (radio du thorax et du squelette, urographie intraveineuse). Dès qu’un cancer invasif du col est décelé, il faut systématiquement procéder à sa classification et enregistrer celle-ci dans le dossier de la patiente sous forme d’un diagramme descriptif. Les examens et les méthodes ayant permis cette classification devront également être précisés.
 table 3.1: Système de classificati...
table 3.1: Système de classificati... figure 3.10: Représentation schéma...
figure 3.10: Représentation schéma...Traitement et pronostic
Dans le cadre d’un traitement standard du cancer du col, on pourra avoir recours soit à la chirurgie, soit à la radiothérapie, soit à une combinaison des deux. Les stades précoces des cancers du col (stade I et IIA) peuvent être traités par l’une ou l’autre de ces méthodes. La radiothérapie constitue le traitement de choix lorsque la maladie s’est étendue au-delà du col et des culs de sac vaginaux, et que la chirurgie dans ce cas n’est plus efficace. Le traitement du cancer du col par radiothérapie peut parfois combiner une radiothérapie externe (pour traiter le pelvis dans sa totalité) et une irradiation intracavitaire (dirigée sur le col). L’irradiation intracavitaire doublée d’une radiothérapie externe est associée à un meilleur contrôle de la maladie et à une meilleure survie, comparé au seul traitement par radiothérapie externe dans le cas d’un cancer localement avancé de stade IIB et III.
Pour traiter un cancer microinvasif (stade IA), on aura recours soit à la conisation, soit à une hystérectomie totale ou élargie. Le traitement des cancers de stade IB et IIA consistera en une hystérectomie radicale (hystérectomie de Wertheim), et une lymphadénectomie pelvienne ou une irradiation intracavitaire, ou une combinaison radiothérapie externe/irradiation intracavitaire. Dans certains cas de petits carcinomes de stade IB (<2 cm), les équipes entrainées pourront avoir recours à une trachélectomie radicale associée à une lymphadénectomie laparoscopique pour préserver les fonctions reproductrices de la patientes. Dans les cas d’un cancer invasif débutant (stades IB et IIA), la radiothérapie et la chirurgie donnent les mêmes résultats. Pour les stades IIB et III, on pourra envisager une radiothérapie externe associée à une irradiation intracavitaire. Les patientes atteintes de cancer de stade IV sont généralement traitées de façon paliative par radiothérapie externe et/ou chimiothérapie.
L’administration en parallèle d’une chimiothérapie au cysplatine améliore les résultats de la radiothérapie dans les cas de cancer du col avancé. Des essais cliniques randomisés ont effectivement montré une amélioration significative de la survie globale avec rémission de la maladie lors de tels traitements conjuguant chimiothérapie au cysplatine et radiothérapie (Thomas, 2000; Green et al., 2001). On a observé un effet bénéfique de la chimio-radiothérapie sur les récidives locales et éloignées. Le bénéfice absolu de cette combinaison thérapeutique en terme de survie globale atteignait 16%. Suite à ces observations, le traitement combiné par chimiothérapie et radiothérapie est en passe de devenir le nouveau traitement de référence pour les cancers avancés du col.
Le stade de la maladie lors de sa détection est le plus important facteur de prédiction de la survie à long terme. Les taux de survie déclinent également avec l’âge. L’état de santé général et le statut nutritionnel sont autant d’autres facteurs influençant la survie. C’est ainsi que les patientes anémiques réagissent faiblement au traitement, de même que celles qui sont séropositives pour le VIH. Plusieurs études cliniques et enquêtes de population ont démontré une survie à cinq ans élevée pour les cancers de stade I (> 75%). Cette survie décline rapidement pour les stades plus avancés (< 10% de stade IV) (Delgado et al., 1990; Fagundes et al., 1992; Kosary et al., 1994; Gatta et al., 1998; Sankaranarayanan et al., 1998; Denton et al., 2000). Dans une large proportion de patientes atteintes d’un cancer du col traité par radiothérapie, on a observé une augmentation de la fréquence des métastases à distance (le plus fréquemment au niveau des ganglions lymphatiques para-aortiques, des poumons, de la cavité abdominale, du foie et du tractus gastro-intestinal) parallèlement à la sévérité du stade de la maladie. Cette fréquence passe en effet de 3% pour les tumeurs de stade IA, à 75% pour les tumeurs de stade IVA (Fagundes et al., 1992). Lors d’une étude portant sur 1028 patientes traitées par une chirurgie radicale, les taux de survie étaient invariablement corrélés avec la taille de la tumeur (Burghardt et al., 1992). Les taux de survie à cinq ans s’échelonnaient entre 91% pour les patientes présentant des tumeurs de taille < 2.5 cm3 et 70% pour celles dont les tumeurs atteignaient 10 à 50 cm3. La survie à trois ans s’étendait entre 94.6% pour les tumeurs de stade I £ 5 mm et 59.5% pour les tumeurs de stade I ³ 21 mm (Delgado et al., 1990). Les stades cliniques avancés sont associés à une fréquence accrue d’invasion des vaisseaux sanguins et lymphatiques et, par conséquent, à une dissémination dans les ganglions lymphatiques pelviens et para-aortiques, et à des métastases à distance.
Pour traiter un cancer microinvasif (stade IA), on aura recours soit à la conisation, soit à une hystérectomie totale ou élargie. Le traitement des cancers de stade IB et IIA consistera en une hystérectomie radicale (hystérectomie de Wertheim), et une lymphadénectomie pelvienne ou une irradiation intracavitaire, ou une combinaison radiothérapie externe/irradiation intracavitaire. Dans certains cas de petits carcinomes de stade IB (<2 cm), les équipes entrainées pourront avoir recours à une trachélectomie radicale associée à une lymphadénectomie laparoscopique pour préserver les fonctions reproductrices de la patientes. Dans les cas d’un cancer invasif débutant (stades IB et IIA), la radiothérapie et la chirurgie donnent les mêmes résultats. Pour les stades IIB et III, on pourra envisager une radiothérapie externe associée à une irradiation intracavitaire. Les patientes atteintes de cancer de stade IV sont généralement traitées de façon paliative par radiothérapie externe et/ou chimiothérapie.
L’administration en parallèle d’une chimiothérapie au cysplatine améliore les résultats de la radiothérapie dans les cas de cancer du col avancé. Des essais cliniques randomisés ont effectivement montré une amélioration significative de la survie globale avec rémission de la maladie lors de tels traitements conjuguant chimiothérapie au cysplatine et radiothérapie (Thomas, 2000; Green et al., 2001). On a observé un effet bénéfique de la chimio-radiothérapie sur les récidives locales et éloignées. Le bénéfice absolu de cette combinaison thérapeutique en terme de survie globale atteignait 16%. Suite à ces observations, le traitement combiné par chimiothérapie et radiothérapie est en passe de devenir le nouveau traitement de référence pour les cancers avancés du col.
Le stade de la maladie lors de sa détection est le plus important facteur de prédiction de la survie à long terme. Les taux de survie déclinent également avec l’âge. L’état de santé général et le statut nutritionnel sont autant d’autres facteurs influençant la survie. C’est ainsi que les patientes anémiques réagissent faiblement au traitement, de même que celles qui sont séropositives pour le VIH. Plusieurs études cliniques et enquêtes de population ont démontré une survie à cinq ans élevée pour les cancers de stade I (> 75%). Cette survie décline rapidement pour les stades plus avancés (< 10% de stade IV) (Delgado et al., 1990; Fagundes et al., 1992; Kosary et al., 1994; Gatta et al., 1998; Sankaranarayanan et al., 1998; Denton et al., 2000). Dans une large proportion de patientes atteintes d’un cancer du col traité par radiothérapie, on a observé une augmentation de la fréquence des métastases à distance (le plus fréquemment au niveau des ganglions lymphatiques para-aortiques, des poumons, de la cavité abdominale, du foie et du tractus gastro-intestinal) parallèlement à la sévérité du stade de la maladie. Cette fréquence passe en effet de 3% pour les tumeurs de stade IA, à 75% pour les tumeurs de stade IVA (Fagundes et al., 1992). Lors d’une étude portant sur 1028 patientes traitées par une chirurgie radicale, les taux de survie étaient invariablement corrélés avec la taille de la tumeur (Burghardt et al., 1992). Les taux de survie à cinq ans s’échelonnaient entre 91% pour les patientes présentant des tumeurs de taille < 2.5 cm3 et 70% pour celles dont les tumeurs atteignaient 10 à 50 cm3. La survie à trois ans s’étendait entre 94.6% pour les tumeurs de stade I £ 5 mm et 59.5% pour les tumeurs de stade I ³ 21 mm (Delgado et al., 1990). Les stades cliniques avancés sont associés à une fréquence accrue d’invasion des vaisseaux sanguins et lymphatiques et, par conséquent, à une dissémination dans les ganglions lymphatiques pelviens et para-aortiques, et à des métastases à distance.



