Accueil / Formation / Manuels / Colposcopie et Traitement des Néoplasies Cervicales Intraépithéliales / Chapitre 13 : Traitement des Néoplasies Cervicales Intraépithéliales par Résection à l’Anse Diathermique (RAD)
 table 13.1: Critères d'éligibilité...
table 13.1: Critères d'éligibilité... table 11.1: Traitement des infecti...
table 11.1: Traitement des infecti... figure 13.3: Instruments nécessair...
figure 13.3: Instruments nécessair... figure 4.9: Spéculum vaginal recou...
figure 4.9: Spéculum vaginal recou...
 figure 13.4: Excision d'une lésion...
figure 13.4: Excision d'une lésion...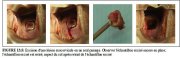 figure 13.5: Excision d'une lésion...
figure 13.5: Excision d'une lésion...
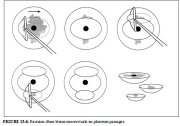 figure 13.6: Excision d'une lésion...
figure 13.6: Excision d'une lésion... figure 13.3: Instruments nécessair...
figure 13.3: Instruments nécessair...
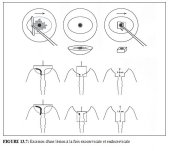 figure 13.7: Excision d'une lésion...
figure 13.7: Excision d'une lésion...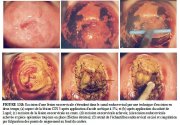 figure 13.8: Excision d'une lésion...
figure 13.8: Excision d'une lésion... figure 13.4: Excision d'une lésion...
figure 13.4: Excision d'une lésion... figure 13.5: Excision d'une lésion...
figure 13.5: Excision d'une lésion... figure 13.6: Excision d'une lésion...
figure 13.6: Excision d'une lésion... FIGURE 13.8: Excision d'une lésion...
FIGURE 13.8: Excision d'une lésion...
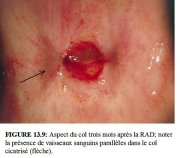 figure 13.9: Aspect du col trois m...
figure 13.9: Aspect du col trois m...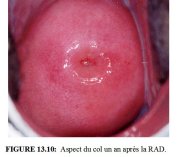 figure 13.10: Aspect du col un an ...
figure 13.10: Aspect du col un an ...
 table 11.1: Traitement des infecti...
table 11.1: Traitement des infecti...
Colposcopie et Traitement des Néoplasies Cervicales Intraépithéliales : Manuel à l'usage des débutants, édité par J.W. Sellors et R. Sankaranarayanan
Chapitre 13 : Traitement des Néoplasies Cervicales Intraépithéliales par Résection à l’Anse Diathermique (RAD)
Autre langue: English / Français / Español / Portugues / ">中文- Selon la puissance et le type d’onde utilisée, le courant électrochirurgical peut provoquer l’un des trois effets suivants sur les tissus auxquels il est appliqué: dessiccation, coupe, et fulguration (étincelle).
- La résection à l’anse diathermique (RAD) est un procédé relativement simple, facile d’apprentissage.
- Le principal avantage de la RAD sur la cryothérapie réside dans le fait qu’elle retire l’épithélium affecté au lieu de le détruire, permettant ainsi son examen histologique après excision.
- Il faut utiliser une anse un peu plus large que la lésion et que la zone de remaniement à enlever, afin de ne pas avoir à faire plusieurs passages pour retirer entièrement la lésion.
- Si la lésion affecte le canal endocervical, on utilisera une méthode d’excision en deux temps.
- Les patientes ont des pertes rouges noires ou marron pendant les deux semaines qui suivent la RAD.
- Les patientes ne doivent pas utiliser de douche vaginale et de tampon, et s’abstenir d’avoir des rapports sexuels pendant le mois qui suit la RAD.
- Des saignements post-opératoires modérés, voire importants, interviennent chez moins de 2% des patientes ainsi traitées qui doivent alors être rapidement réexaminées.
- Le taux d’échec de la RAD parmi les femmes traitées pour la première fois est d’environ 10%.
L’électrochirurgie consiste à utiliser un courant électrique HF (radiofréquence) pour inciser un tissu ou pratiquer l’hémostase. L’opérateur qui utilise la résection à l’anse diathermique (RAD) doit toujours garder à l’esprit que l’électricité circule vers la masse en suivant le chemin de moindre résistance électrique. L’énergie électrique dont on se sert en électrochirurgie est transformée en chaleur et en énergie lumineuse. La chaleur obtenue à partir d’un arc électrique de haute tension entre l’électrode et le tissu, permet au praticien de sectionner en vaporisant le tissu (à 100oC) ou de coaguler en déshydratant le tissu (au-dessus de 100oC). Les électrodes de coupure ont l’aspect de très fines anses (0.2 mm) métalliques en inox ou en tungstène. Elles permettent de couper selon diverses configurations, à des profondeurs et à des largeurs différentes (Figure 13.1).
La coagulation utilise des températures plus élévées, provoquant des effets thermiques plus importants, que lors de l’incision électrochirurgicale. Il est important d’en tenir compte en électrochirurgie, dans la mesure où si l’on souhaite procéder à un examen histo-pathologique du tissu excisé, l’effet coagulateur doit être minimal. Cependant, il est souhaitable d’obtenir un effet coagulateur, même pendant l’incision, de façon à minimiser les saignements dans le champ opératoire. Les fabricants des générateurs électrochirurgicaux les plus récents (Figure 13.2) ont parfaitement conscience de cette nécessité de contrôler les saignements tout en incisant. Ils proposent donc des appareillages d’électrochirurgie qui permettent de réaliser la double fonction de coupe et de coagulation en alliant deux fréquences électriques, l’une pour sectionner, l’autre pour coaguler. On parle d’appareil bipolaire. C’est à ce type de matériel que nous nous référons dans le présent ouvrage.
Lorsqu’on sélectionne la fonction de coagulation sur le générateur électrochirurgical, l’amplitude crête à crête de la tension de coagulation est plus grande (production de températures plus élevées) que pour la tension de coupe pure. Cette tension de coagulation est uniquement destinée à chauffer le tissu à plus de 100°C afin de le déshydrater. Il existe trois types de coagulation : la dessiccation, au cours de laquelle l’électrode active est en contact avec le tissu ; la fulguration, au cours de laquelle l’électrode active n’est pas en contact avec le tissu, mais projette des étincelles entre sa pointe et le tissu ; et la coagulation par piqûre, au cours de laquelle une électrode, habituellement une aiguille, est introduite au centre de la lésion. Dans cet ouvrage nous ferons généralement référence à la coagulation par fulguration avec une électrode à boule de 3 à 5mm (à une exception près : l’emploi d’une électrode à aiguille pour coaguler une zone de saignement persistante). La coagulation par fulguration utilise des tensions d’amplitude crête à crête plus élevées que pour les autres formes de coagulation. Cela permet de coaguler les tissus avec moins de courant électrique, et par conséquent, moins d’effets dommageables pour les tissus adjacents.
Pour fonctionner correctement, un générateur électrochirurgical nécessite l’emploi d’une électrode neutre (électrode de retour au patient) ou d’une large plaque de dispersion afin d’assurer le passage du courant électrique et sa dispersion de façon optimale. La plaque de dispersion doit toujours être placée le plus près possible du site chirurgical. A l’inverse, au niveau de l’électrode active, l’intensité de courant est délibérément élevée pour concentrer l’énergie électrique puisque c’est celle-ci qui est transformée en chaleur. Si l’on ne maintient pas un bon contact électrique avec l’électrode neutre sur une large surface, il y a risque de brûlures pour le patient. Afin de prévenir ce genre d’accident, les nouvelles unités électrochirurgicales disposent d’un circuit (habituellement considéré comme un système de surveillance de l’électrode neutre) qui contrôle en permanence si le contact entre le patient et la masse (plaque de dispersion) est correct. Ce type de circuit non seulement alerte l’opérateur en cas de problème, mais empêche également l’intervention tant que le défaut n’a pas été rectifié. Il est vivement recommandé de s’assurer que tout générateur électrochirurgical répond aux principales normes citées ci-dessus afin de garantir une pratique efficace et sans danger de l’électrochirurgie. Seuls des systèmes répondant ou dépassant ces normes sont censés être utilisés pour réaliser chacune des méthodes électrochirurgicales décrites dans ce manuel.
L’électrochirurgie ne doit pas être pratiquée en présence d’objets, de gaz, d’anesthésiques ou de liquides inflammables (par exemple, solutions ou teintures de préparation de l’épiderme contenant de l’alcool), d’agents oxydants, ou dans une atmosphère enrichie en oxygène. L’opérateur court bien entendu le risque de se brûler avec l’électrode active s’il la touche par mégarde alors que le courant passe.
La coagulation utilise des températures plus élévées, provoquant des effets thermiques plus importants, que lors de l’incision électrochirurgicale. Il est important d’en tenir compte en électrochirurgie, dans la mesure où si l’on souhaite procéder à un examen histo-pathologique du tissu excisé, l’effet coagulateur doit être minimal. Cependant, il est souhaitable d’obtenir un effet coagulateur, même pendant l’incision, de façon à minimiser les saignements dans le champ opératoire. Les fabricants des générateurs électrochirurgicaux les plus récents (Figure 13.2) ont parfaitement conscience de cette nécessité de contrôler les saignements tout en incisant. Ils proposent donc des appareillages d’électrochirurgie qui permettent de réaliser la double fonction de coupe et de coagulation en alliant deux fréquences électriques, l’une pour sectionner, l’autre pour coaguler. On parle d’appareil bipolaire. C’est à ce type de matériel que nous nous référons dans le présent ouvrage.
Lorsqu’on sélectionne la fonction de coagulation sur le générateur électrochirurgical, l’amplitude crête à crête de la tension de coagulation est plus grande (production de températures plus élevées) que pour la tension de coupe pure. Cette tension de coagulation est uniquement destinée à chauffer le tissu à plus de 100°C afin de le déshydrater. Il existe trois types de coagulation : la dessiccation, au cours de laquelle l’électrode active est en contact avec le tissu ; la fulguration, au cours de laquelle l’électrode active n’est pas en contact avec le tissu, mais projette des étincelles entre sa pointe et le tissu ; et la coagulation par piqûre, au cours de laquelle une électrode, habituellement une aiguille, est introduite au centre de la lésion. Dans cet ouvrage nous ferons généralement référence à la coagulation par fulguration avec une électrode à boule de 3 à 5mm (à une exception près : l’emploi d’une électrode à aiguille pour coaguler une zone de saignement persistante). La coagulation par fulguration utilise des tensions d’amplitude crête à crête plus élevées que pour les autres formes de coagulation. Cela permet de coaguler les tissus avec moins de courant électrique, et par conséquent, moins d’effets dommageables pour les tissus adjacents.
Pour fonctionner correctement, un générateur électrochirurgical nécessite l’emploi d’une électrode neutre (électrode de retour au patient) ou d’une large plaque de dispersion afin d’assurer le passage du courant électrique et sa dispersion de façon optimale. La plaque de dispersion doit toujours être placée le plus près possible du site chirurgical. A l’inverse, au niveau de l’électrode active, l’intensité de courant est délibérément élevée pour concentrer l’énergie électrique puisque c’est celle-ci qui est transformée en chaleur. Si l’on ne maintient pas un bon contact électrique avec l’électrode neutre sur une large surface, il y a risque de brûlures pour le patient. Afin de prévenir ce genre d’accident, les nouvelles unités électrochirurgicales disposent d’un circuit (habituellement considéré comme un système de surveillance de l’électrode neutre) qui contrôle en permanence si le contact entre le patient et la masse (plaque de dispersion) est correct. Ce type de circuit non seulement alerte l’opérateur en cas de problème, mais empêche également l’intervention tant que le défaut n’a pas été rectifié. Il est vivement recommandé de s’assurer que tout générateur électrochirurgical répond aux principales normes citées ci-dessus afin de garantir une pratique efficace et sans danger de l’électrochirurgie. Seuls des systèmes répondant ou dépassant ces normes sont censés être utilisés pour réaliser chacune des méthodes électrochirurgicales décrites dans ce manuel.
L’électrochirurgie ne doit pas être pratiquée en présence d’objets, de gaz, d’anesthésiques ou de liquides inflammables (par exemple, solutions ou teintures de préparation de l’épiderme contenant de l’alcool), d’agents oxydants, ou dans une atmosphère enrichie en oxygène. L’opérateur court bien entendu le risque de se brûler avec l’électrode active s’il la touche par mégarde alors que le courant passe.
S’exercer à la RAD et justifier de sa compétence avant de l’employer sur des patientes
Chaque colposcopiste doit obligatoirement s’entraîner à la RAD et justifier de sa compétence en la matière en simulant des excisions de lésions cervicales sur de la viande (bœuf, porc, etc.) ou des fruits, sur lesquels on aura peint à l’échelle de fausses lésions avec du liquide correcteur pour machine à écrire ou de l’acide trichloracétique. La RAD doit toujours être pratiquée sous colposcopie. Si possible, les colposcopistes devront justifier d’une expérience en cryothérapie avant d’apprendre la RAD.
Approche étape par étape de la RAD
Tout d’abord, il faut s’assurer que la patiente répond aux critères d’éligibilité du Tableau 13.1.
S’il y a le moindre signe de maladie inflammatoire pelvienne (MIP), de cervicite, de trichomoniase vaginale, de vaginose bactérienne ou d’ulcérations anogénitales, il est conseillé de retarder la RAD jusqu’à ce que l’affection de cette patiente ait été traitée et guérie (confère Chapitre 11, Tableau 11.1). De la même façon, si on constate une nette atrophie du col liée à un déficit en œstrogènes chez une femme plus âgée et que la coloration du contour externe de la lésion est floue, il est préférable de retarder la RAD jusqu’à ce qu’un traitement à base d’œstrogènes ait fait son effet.
Il est généralement souhaitable d’avoir un diagnostic ferme de CIN avant de procéder à une RAD. Il existe cependant quelques exceptions à cette règle. Par exemple, dans les pays en développement, on proposera parfois cette intervention aux femmes aussitôt après l’examen colposcopique au cours de la même consultation, de façon à maximiser la couverture du traitement (sinon les patientes qui ne se font pas suivre ne recevront aucun traitement). Les colposcopistes expérimentés peuvent également choisir cette approche afin, non seulement de maximiser la couverture de traitement, mais aussi de réduire le nombre de consultations.
Les instruments nécessaires à la RAD doivent être disposés sur un chariot ou sur un plateau (Figure 13.3). Si la RAD n’est pas pratiquée immédiatement après la colposcopie, mais lors d’une seconde consultation (après confirmation histologique de la lésion à traiter), il faut renouveler l’examen colposcopique juste avant le traitement pour s’assurer que la localisation et l’étendue linéaire de la lésion répondent bien aux conditions requises pour une RAD efficace. L’application du soluté de Lugol facilitera la délimitation des contours de la lésion avant de débuter le traitement. Il faut employer un spéculum vaginal électriquement isolé (Figure 13.3) ou un spéculum recouvert d’un préservatif en latex (Figure 4.9), afin d’éviter tout choc électrique pour la patiente au cas ou l’électrode active toucherait le spéculum par accident (bien que ce type d’accident ne provoque aucun dommage tissulaire à cause de la surface de contact relativement large). De la même façon, il faut prendre soin de ne pas faire mal à la patiente en touchant par inadvertance les parois vaginales avec l’électrode active. On peut facilement éviter ce genre d’accident en utilisant un rétracteur des parois vaginales électriquement isolé en plus du spéculum lui aussi électriquement isolé (Figure 13.3) ou recouvert d’un préservatif en latex (Figure 4.9).
L’idéal est d’utiliser un spéculum vaginal doté d’un tube évacuateur de fumée fixé à la surface luminale de la lame antérieure, de sorte qu’on puisse y brancher une simple source d’aspiration. Si l’on ne dispose pas d’un tel type de spéculum, il est possible d’utiliser un banal tuyau d’aspiration (de préférence fait d’un matériau non conductible et ininflammable) dont l’ouverture sera placée aussi proche que possible du col. Il est indispensable de disposer d’un système d’aspiration de fort débit et d’un moyen de filtration des odeurs et des particules de fumée.
Il suffit de 30 secondes pour réaliser une anesthésie locale du col par plusieurs injections dans le tissu stromal du col de xylocaïne à 1% (total de 5 ml, voire moins) ou d’un produit similaire. Les injections sont réalisées selon un cercle de 1 à 2 mm de profondeur (à 3, 6, 9 et 12 heures) à la périphérie de la lésion et de la zone de remaniement. Pour ce faire, on utilisera une seringue de 5 ml avec une aiguille de jauge 25 à 27. Pour réduire les saignements pendant l’intervention, il est courant de mélanger un produit vasoconstricteur comme la vasopressine (pas plus d’une unité d’hypertenseur) avec l’anesthésique local. On peut également utiliser pour l’anesthésie locale de la xylocaïne avec 2% d’adrénaline au lieu de pitressine. Ce mélange peut cependant provoquer des palpitations et des tremblements des membres inférieurs avant l’intervention, désagréments qu’il est possible d’éviter si l’infiltration est sous-épithéliale. Quand on envisage une RAD en deux temps, l’anesthésique local sera également injecté dans les parois antérieure et postérieure du canal endocervical.
L’approche par RAD permet de retirer les lésions et la zone de remaniement dans leur totalité, de sorte que les tissus puissent être envoyés au laboratoire d’histopathologie. C’est pourquoi, on utilisera le minimum de puissance électrique nécessaire à une électrochirurgie efficace, de façon à minimiser les dommages pour les tissus normaux environnants et procurer aussi à l’analyse histopathologique un échantillon acceptable (présentant un minimum d’artéfacts thermiques). Le choix de la puissance à utiliser dépend de la taille de l’électrode employée pour l’excision, et s’il est prévu ou non d’effectuer une coagulation par fulguration. Ce type d’information doit donc être prédéterminé pour chaque cas, et communiqué à l’opérateur de la RAD au moment du choix des puissances de coupe ou de fulguration. On utilise généralement les puissances suivantes pour les différentes électrode à anse : 1.0 ´ 1.0 cm 30 watts ; 1.5 ´ 0.5 cm 35 watts ; 2.0 ´ 0.8 cm 40 watts ; 2.0 ´ 1.2 cm 50 watts. Quand il s’agit d’électrodes à boules de 3 mm et 5 mm, on utilise respectivement 30 watts et 50 watts, pour la fonction coagulation. Dans la mesure du possible, il faut essayer de prélever la lésion par un seul passage de l’anse. Malheureusement, ce n’est pas toujours possible. Il existe quatre principaux scénari opératoires qui sont décrits ci-dessous.
Il est généralement souhaitable d’avoir un diagnostic ferme de CIN avant de procéder à une RAD. Il existe cependant quelques exceptions à cette règle. Par exemple, dans les pays en développement, on proposera parfois cette intervention aux femmes aussitôt après l’examen colposcopique au cours de la même consultation, de façon à maximiser la couverture du traitement (sinon les patientes qui ne se font pas suivre ne recevront aucun traitement). Les colposcopistes expérimentés peuvent également choisir cette approche afin, non seulement de maximiser la couverture de traitement, mais aussi de réduire le nombre de consultations.
Les instruments nécessaires à la RAD doivent être disposés sur un chariot ou sur un plateau (Figure 13.3). Si la RAD n’est pas pratiquée immédiatement après la colposcopie, mais lors d’une seconde consultation (après confirmation histologique de la lésion à traiter), il faut renouveler l’examen colposcopique juste avant le traitement pour s’assurer que la localisation et l’étendue linéaire de la lésion répondent bien aux conditions requises pour une RAD efficace. L’application du soluté de Lugol facilitera la délimitation des contours de la lésion avant de débuter le traitement. Il faut employer un spéculum vaginal électriquement isolé (Figure 13.3) ou un spéculum recouvert d’un préservatif en latex (Figure 4.9), afin d’éviter tout choc électrique pour la patiente au cas ou l’électrode active toucherait le spéculum par accident (bien que ce type d’accident ne provoque aucun dommage tissulaire à cause de la surface de contact relativement large). De la même façon, il faut prendre soin de ne pas faire mal à la patiente en touchant par inadvertance les parois vaginales avec l’électrode active. On peut facilement éviter ce genre d’accident en utilisant un rétracteur des parois vaginales électriquement isolé en plus du spéculum lui aussi électriquement isolé (Figure 13.3) ou recouvert d’un préservatif en latex (Figure 4.9).
L’idéal est d’utiliser un spéculum vaginal doté d’un tube évacuateur de fumée fixé à la surface luminale de la lame antérieure, de sorte qu’on puisse y brancher une simple source d’aspiration. Si l’on ne dispose pas d’un tel type de spéculum, il est possible d’utiliser un banal tuyau d’aspiration (de préférence fait d’un matériau non conductible et ininflammable) dont l’ouverture sera placée aussi proche que possible du col. Il est indispensable de disposer d’un système d’aspiration de fort débit et d’un moyen de filtration des odeurs et des particules de fumée.
Il suffit de 30 secondes pour réaliser une anesthésie locale du col par plusieurs injections dans le tissu stromal du col de xylocaïne à 1% (total de 5 ml, voire moins) ou d’un produit similaire. Les injections sont réalisées selon un cercle de 1 à 2 mm de profondeur (à 3, 6, 9 et 12 heures) à la périphérie de la lésion et de la zone de remaniement. Pour ce faire, on utilisera une seringue de 5 ml avec une aiguille de jauge 25 à 27. Pour réduire les saignements pendant l’intervention, il est courant de mélanger un produit vasoconstricteur comme la vasopressine (pas plus d’une unité d’hypertenseur) avec l’anesthésique local. On peut également utiliser pour l’anesthésie locale de la xylocaïne avec 2% d’adrénaline au lieu de pitressine. Ce mélange peut cependant provoquer des palpitations et des tremblements des membres inférieurs avant l’intervention, désagréments qu’il est possible d’éviter si l’infiltration est sous-épithéliale. Quand on envisage une RAD en deux temps, l’anesthésique local sera également injecté dans les parois antérieure et postérieure du canal endocervical.
L’approche par RAD permet de retirer les lésions et la zone de remaniement dans leur totalité, de sorte que les tissus puissent être envoyés au laboratoire d’histopathologie. C’est pourquoi, on utilisera le minimum de puissance électrique nécessaire à une électrochirurgie efficace, de façon à minimiser les dommages pour les tissus normaux environnants et procurer aussi à l’analyse histopathologique un échantillon acceptable (présentant un minimum d’artéfacts thermiques). Le choix de la puissance à utiliser dépend de la taille de l’électrode employée pour l’excision, et s’il est prévu ou non d’effectuer une coagulation par fulguration. Ce type d’information doit donc être prédéterminé pour chaque cas, et communiqué à l’opérateur de la RAD au moment du choix des puissances de coupe ou de fulguration. On utilise généralement les puissances suivantes pour les différentes électrode à anse : 1.0 ´ 1.0 cm 30 watts ; 1.5 ´ 0.5 cm 35 watts ; 2.0 ´ 0.8 cm 40 watts ; 2.0 ´ 1.2 cm 50 watts. Quand il s’agit d’électrodes à boules de 3 mm et 5 mm, on utilise respectivement 30 watts et 50 watts, pour la fonction coagulation. Dans la mesure du possible, il faut essayer de prélever la lésion par un seul passage de l’anse. Malheureusement, ce n’est pas toujours possible. Il existe quatre principaux scénari opératoires qui sont décrits ci-dessous.
 table 13.1: Critères d'éligibilité...
table 13.1: Critères d'éligibilité... table 11.1: Traitement des infecti...
table 11.1: Traitement des infecti... figure 13.3: Instruments nécessair...
figure 13.3: Instruments nécessair... figure 4.9: Spéculum vaginal recou...
figure 4.9: Spéculum vaginal recou...Excision d’une lésion de l’exocol par un seul passage (Figures 13.4 et 13.5)
La largeur de l’anse de l’électrode doit dépasser celle de la lésion et de la zone de remaniement à enlever. La hauteur de l’anse doit être d’au moins 5 mm (hauteur entre la barre transversale et la partie la plus éloignée de l’arc métallique). On utilisera souvent une électrode à anse ovale de 2.0 ´ 0.8 cm. Pour conserver une géométrie et une profondeur de coupe régulières, il est souhaitable d’orienter la surface de l’exocol selon l’angle le plus propice à la manipulation de l’électrode à couper – c’est à dire, garder la barre transversale parallèle à l’exocol. Pour commencer, l’opérateur administre l’anesthésique local. Puis, il règle le générateur électrochirurgical sur la puissance désirée et sur le mode de coupe bipolaire. Enfin, il met en marche le système d’évacuation de la fumée. Quand l’anse de l’électrode est positionnée juste au-dessus du point de démarrage, mais qu’elle ne touche pas encore la surface du col, l’opérateur active le passage du courant à l’aide d’une pédale ou d’un bouton sur le manche de l’électrode. L’anse est ensuite introduite dans le tissu, à 5mm de distance extérieure des bords externes de la lésion. Il est important de ne pas appuyer sur l’électrode, mais de la laisser couper à son rythme, en lui imprimant simplement un mouvement d’orientation pour la guider. Progressivement, l’anse pénètre dans le tissu cervical jusqu’à ce que la barre transversale vienne au contact de la surface épithéliale. L’anse est ensuite guidée parallèlement à la surface (horizontalement ou verticalement en fonction de l’angle de coupe) jusqu’à ce que le bord opposé de la lésion soit atteint. L’anse est ensuite retirée doucement, perpendiculairement à la surface en direction de l’opérateur. Le courant est coupé dès que l’anse a extrait le tissu. Que l’excision soit pratiquée de droite à gauche ou vice versa, n’a aucune importance. Il est également possible de passer l’anse de bas en haut. En revanche, il ne faut pas faire l’inverse, c’est à dire de haut en bas, car le sang ou le tissu excisé, en glissant vers le bas, risquent d’obstruer le champ visuel.
Une fois l’échantillon placé dans le formol, l’opérateur règle l’appareil électrochirurgical sur la fonction fulguration et sélectionne la puissance adéquate. La surface de l’entonnoir excisé est fulgurée à l’aide d’une électrode à boule de 3 ou 5 mm réglée sur le mode coagulation au niveau d’éventuels points de saignements. Les bords de l’entonnoir peuvent également être fulgurés afin de préserver la jonction pavimento-cylindrique sur la partie visible de l’exocol. Si l’opérateur à du mal à résorber les saignements avec l’électrode à boule, il peut, le cas échéant, utiliser une électrode à macro aiguille pour concentrer et focaliser le courant de fulguration (plus forte intensité de courant) sur un site de saignement précis. Quand l’hémostase est achevée, la surface du cratère est alors enduite de solution de Monsel avant de retirer le spéculum. Les saignements sont souvent plus importants chez les patientes extrêmement nerveuses que chez les patientes parfaitement détendues - raison de plus pour leur parler tout au long de l’intervention et tenter de les rassurer.
Si malgré tout, il est difficile de stopper les saignements à l’aide des techniques précédentes, il faut enduire généreusement la base de l’entonnoir formé par l’excision avec de la solution de Monsel et remplir le vagin avec un tampon de gaze que la femme ne devra pas retirer avant plusieurs heures. Cette complication s’observe plus fréquemment chez les patientes souffrant d’une cervicite.
Une fois l’échantillon placé dans le formol, l’opérateur règle l’appareil électrochirurgical sur la fonction fulguration et sélectionne la puissance adéquate. La surface de l’entonnoir excisé est fulgurée à l’aide d’une électrode à boule de 3 ou 5 mm réglée sur le mode coagulation au niveau d’éventuels points de saignements. Les bords de l’entonnoir peuvent également être fulgurés afin de préserver la jonction pavimento-cylindrique sur la partie visible de l’exocol. Si l’opérateur à du mal à résorber les saignements avec l’électrode à boule, il peut, le cas échéant, utiliser une électrode à macro aiguille pour concentrer et focaliser le courant de fulguration (plus forte intensité de courant) sur un site de saignement précis. Quand l’hémostase est achevée, la surface du cratère est alors enduite de solution de Monsel avant de retirer le spéculum. Les saignements sont souvent plus importants chez les patientes extrêmement nerveuses que chez les patientes parfaitement détendues - raison de plus pour leur parler tout au long de l’intervention et tenter de les rassurer.
Si malgré tout, il est difficile de stopper les saignements à l’aide des techniques précédentes, il faut enduire généreusement la base de l’entonnoir formé par l’excision avec de la solution de Monsel et remplir le vagin avec un tampon de gaze que la femme ne devra pas retirer avant plusieurs heures. Cette complication s’observe plus fréquemment chez les patientes souffrant d’une cervicite.
 figure 13.4: Excision d'une lésion...
figure 13.4: Excision d'une lésion... figure 13.5: Excision d'une lésion...
figure 13.5: Excision d'une lésion...Excision d’une lésion de l’exocol par plusieurs passages (Figure 13.6)
Si le diamètre de la lésion dépasse la largeur de l’anse la plus large (habituellement 2 cm), il est possible de retirer cette lésion en effectuant plusieurs passages avec une ou plusieurs tailles d’anse. On utilise généralement la méthode de base décrite plus haut (Figure 13.3) pour retirer d’abord la partie centrale de la lésion. Les restes de la lésion en périphérie sont ensuite excisés par un ou plusieurs passages. Tous les tissus prélevés sont conservés aux fins de l’examen histopathologique.
 figure 13.6: Excision d'une lésion...
figure 13.6: Excision d'une lésion... figure 13.3: Instruments nécessair...
figure 13.3: Instruments nécessair...Excision d’une lésion affectant l’exocol et l’endocol (Figures 13.7 et 13.8)
Lorsqu’une lésion affecte le canal endocervical, il est peu probable qu’on réussisse à la retirer avec la technique habituelle du passage en une seule fois décrit plus haut (Figures 13.4 et 13.5). En effet, la profondeur atteinte avec cette approche n’est pas suffisante. On utilise alors une méthode d’excision en deux temps. Quand les lésions affectent le canal, la plupart d’entre elles s’étendent sur une hauteur de moins d’1 cm dans le canal endocervical. Cependant, chez les femmes plus âgées et dans les cas de CIN 3, ces lésions peuvent être plus étendues et nécessiter l’excision d’une deuxième couche tissulaire – comportant uniquement du tissu du canal endocervical.
On peut généralement exciser la portion exocervicale de ce type de lésion qui s’étend dans le canal, par un premier passage à l’aide d’une large anse ovale (2.0 ´ 0.8 cm). On retire ensuite le tissu restant dans le canal à l’aide d’une anse plus petite – habituellement une anse de forme carrée de 1.0 ´ 1.0 cm – mais il faut faire attention à ne pas plonger plus profond qu’il n’est nécessaire pour exciser complètement la lésion avec une petite marge de tissu sain. Ce type d’excision peut atteindre une profondeur maximum de 1.6 cm à l’intérieur du canal endocervical (Figure 13.7) et ne doit être tentée qu’en cas de nécessité absolue en raison du risque d’hémorragie et de sténose qui augmente avec la profondeur de l’excision. Dans la mesure où cette technique d’excision en deux temps est relativement délicate à effectuer, il est recommandé à l’opérateur de ne pas tenter ce genre d’intervention tant qu’il n’est pas parfaitement à l’aise et compétent avec la méthode de base de la RAD. Pour les femmes dont les lésions s’étendent plus loin dans le canal (c’est à dire si le sommet ou la partie distale de la lésion n’est pas visible ou que cette lésion s’étend sur plus de 1 cm dans le canal), on aura recours à la conisation à froid.
Lésion avec extension vaginale
Quand la lésion s’étend dans le vagin, il est préférable d’employer une électrode à boule pour procéder à la fulguration de la portion vaginale périphérique de la lésion, et une électrode à anse diathermique pour traiter la partie centrale et cervicale de la lésion. Le traitement des lésions vaginales dépasse le cadre de cet ouvrage. Le traitement par RAD auquel nous faisons référence ici ne s’adresse qu’aux types de lésions exposées dans les Figures 13.4 et 13.6-13.8 et décrites ci-dessus. Le lecteur intéressé pourra consulter d’autres ouvrages de référence (Wright et al., 1992; Wright et al., 1995).
On peut généralement exciser la portion exocervicale de ce type de lésion qui s’étend dans le canal, par un premier passage à l’aide d’une large anse ovale (2.0 ´ 0.8 cm). On retire ensuite le tissu restant dans le canal à l’aide d’une anse plus petite – habituellement une anse de forme carrée de 1.0 ´ 1.0 cm – mais il faut faire attention à ne pas plonger plus profond qu’il n’est nécessaire pour exciser complètement la lésion avec une petite marge de tissu sain. Ce type d’excision peut atteindre une profondeur maximum de 1.6 cm à l’intérieur du canal endocervical (Figure 13.7) et ne doit être tentée qu’en cas de nécessité absolue en raison du risque d’hémorragie et de sténose qui augmente avec la profondeur de l’excision. Dans la mesure où cette technique d’excision en deux temps est relativement délicate à effectuer, il est recommandé à l’opérateur de ne pas tenter ce genre d’intervention tant qu’il n’est pas parfaitement à l’aise et compétent avec la méthode de base de la RAD. Pour les femmes dont les lésions s’étendent plus loin dans le canal (c’est à dire si le sommet ou la partie distale de la lésion n’est pas visible ou que cette lésion s’étend sur plus de 1 cm dans le canal), on aura recours à la conisation à froid.
Lésion avec extension vaginale
Quand la lésion s’étend dans le vagin, il est préférable d’employer une électrode à boule pour procéder à la fulguration de la portion vaginale périphérique de la lésion, et une électrode à anse diathermique pour traiter la partie centrale et cervicale de la lésion. Le traitement des lésions vaginales dépasse le cadre de cet ouvrage. Le traitement par RAD auquel nous faisons référence ici ne s’adresse qu’aux types de lésions exposées dans les Figures 13.4 et 13.6-13.8 et décrites ci-dessus. Le lecteur intéressé pourra consulter d’autres ouvrages de référence (Wright et al., 1992; Wright et al., 1995).
 figure 13.7: Excision d'une lésion...
figure 13.7: Excision d'une lésion... figure 13.8: Excision d'une lésion...
figure 13.8: Excision d'une lésion... figure 13.4: Excision d'une lésion...
figure 13.4: Excision d'une lésion... figure 13.5: Excision d'une lésion...
figure 13.5: Excision d'une lésion... figure 13.6: Excision d'une lésion...
figure 13.6: Excision d'une lésion... FIGURE 13.8: Excision d'une lésion...
FIGURE 13.8: Excision d'une lésion...Suivi après une RAD
Les femmes seront informées des précautions à prendre et des symptômes consécutifs au traitement. Si besoin est, on leur donnera une information écrite. Elles doivent être prévenues des pertes vaginales rouges brunes ou noires qui se produiront pendant quelques jours jusqu’à deux semaines après l’intervention. En revanche, si ces pertes se prolongent au-delà des deux semaines, si elles deviennent nauséabondes, associées ou non à des douleurs pelviennes, ou si un saignement abondant se déclenche, on conseillera aux patientes de le signaler rapidement. On leur recommandera aussi de ne pas utiliser de douche vaginale ou de tampons, et de s’abstenir d’avoir des rapports sexuels pendant le mois qui suit l’intervention. Les Figures 13.9 et 13.10 illustrent l’aspect du col trois mois et un an après une RAD.
On ne connaît pas l’effet du traitement par RAD sur la transmissibilité éventuelle du VIH (à la patiente ou à partir de celle-ci) pendant la phase de cicatrisation. Wright et al., (2001) ont cependant observé la présence de VIH-1 dans les sécrétions vaginales de femmes séropositives traitées par RAD pour une CIN. Ils proposent donc de prévenir toutes les patientes que ce traitement est susceptible d’augmenter la transmissibilité du VIH et que l’utilisation du préservatif est un bon moyen de prévention pendant un minimum de 6 à 8 semaines après l’intervention. Dans les milieux où l’infection à VIH est endémique, il faudrait les distribuer gratuitement lors des consultations colposcopiques.
Une visite de contrôle doit être prévue 9 à 12 mois après le traitement. L’organisation de la prise en charge suit le même schéma que celui qui est précisé au Chapitre 11. Le prochain paragraphe traite de l’organisation de la prise en charge des femmes pour lesquelles les visites de contrôle mettent en évidence une persistance de la maladie.
 figure 13.9: Aspect du col trois m...
figure 13.9: Aspect du col trois m... figure 13.10: Aspect du col un an ...
figure 13.10: Aspect du col un an ...Effets secondaires, complications et séquelles à long terme de la RAD
La plupart des femmes ressentent une douleur passagère lors de l’injection de l’anesthésique local dans le col. Dans moins de 2% des traitements par RAD, l’opérateur peut être confronté à de sérieux saignements péri-opératoires. Il faut bien entendu conseiller aux patientes de prévenir le centre médical si elles éprouvent une quelconque inquiétude durant la période post-opératoire. Les recommandations post-opératoires, par écrit de préférence, devront préciser les points suivants. Peu de femmes se plaignent de douleurs post-opératoires. Toutefois, si c’est le cas, il s’agit en général de contractions utérines. La patiente pourra alors recourir aux antalgiques par voie orale comme l’acétaminophène ou l’ibuprofène. Les pertes muqueuses marron foncé (à cause de la solution de Monsel), teintées de sang, durent une à deux semaines après le traitement. Cependant, des saignements post-opératoires modérés ou abondants se déclenchent parfois chez un petit nombre de patientes qui doivent alors être rapidement réexaminées. Le col cicatrise généralement dans le mois qui suit l’intervention.
L’hémorragie post-opératoire, si elle a lieu, se déclenche généralement 4 à 6 jours après le traitement, très souvent à partir de la lèvre postérieure du col. Habituellement, une coagulation par fulguration, l’application de la solution de Monsel ou de nitrate d’argent, suffisent à enrayer l’hémorragie. Il est rarement nécessaire de placer un point de suture au site de saignement. Le risque d’infection post-opératoire est très faible. Il peut encore être aisément réduit en retardant le traitement chirurgical chez toute femme souffrant de MIP, de cervicite, de trichomoniase vaginale ou de vaginose bactérienne. On cattendra que l’affection ait été correctement traitée et guérie. Lorsqu’une patiente se plaint de pertes malodorantes après l’opération, il est indispensable de faire une culture et de prescrire un traitement empirique avec des antibiotiques efficaces contre les MIP (confère Tableau 11.1). Dans les pays en développement, il sera peut-être plus prudent de prescrire un traitement antibiotique préventif systématique après une RAD (doxycycline 100 mg par voie orale, deux fois par jour, pendant sept jours et métronidazole 400 mg par voie orale, trois fois par jour, pendant sept jours).
Lors de le visite de contrôle, chez près de 2% des femmes, la jonction pavimento-cylindrique est située dans le canal endocervical. Cela rend difficile l’examen colposcopique et le prélèvement cytologique. Si la sténose du col, partielle ou totale, est peu fréquente (probablement moins de 1% des cas), elle est plus souvent rencontrée chez les femmes ménopausées. Les patientes doivent en être averties.
L’hémorragie post-opératoire, si elle a lieu, se déclenche généralement 4 à 6 jours après le traitement, très souvent à partir de la lèvre postérieure du col. Habituellement, une coagulation par fulguration, l’application de la solution de Monsel ou de nitrate d’argent, suffisent à enrayer l’hémorragie. Il est rarement nécessaire de placer un point de suture au site de saignement. Le risque d’infection post-opératoire est très faible. Il peut encore être aisément réduit en retardant le traitement chirurgical chez toute femme souffrant de MIP, de cervicite, de trichomoniase vaginale ou de vaginose bactérienne. On cattendra que l’affection ait été correctement traitée et guérie. Lorsqu’une patiente se plaint de pertes malodorantes après l’opération, il est indispensable de faire une culture et de prescrire un traitement empirique avec des antibiotiques efficaces contre les MIP (confère Tableau 11.1). Dans les pays en développement, il sera peut-être plus prudent de prescrire un traitement antibiotique préventif systématique après une RAD (doxycycline 100 mg par voie orale, deux fois par jour, pendant sept jours et métronidazole 400 mg par voie orale, trois fois par jour, pendant sept jours).
Lors de le visite de contrôle, chez près de 2% des femmes, la jonction pavimento-cylindrique est située dans le canal endocervical. Cela rend difficile l’examen colposcopique et le prélèvement cytologique. Si la sténose du col, partielle ou totale, est peu fréquente (probablement moins de 1% des cas), elle est plus souvent rencontrée chez les femmes ménopausées. Les patientes doivent en être averties.
 table 11.1: Traitement des infecti...
table 11.1: Traitement des infecti...Prise en charge des femmes présentant des lésions persistantes lors de la visite de contrôle
Toutes les femmes doivent se présenter à une visite de contrôle, 9 à 12 mois après l’intervention, indépendamment des résultats de l’histo-pathologie dont le compte rendu précisera si les bords de l’excision sont sains ou non. Cette visite de contrôle est destinée à évaluer la régression ou la persistance des lésions et d’éventuelles complications. Lors de ce suivi, on constate un échec du traitement (lésion persistante) dans moins de 10% des cas. Il est bien entendu conseillé de faire une biopsie de toutes les lésions persistantes de façon à éliminer avec certitude la possibilité d’un carcinome invasif insoupçonné. Les lésions persistantes seront à nouveau traitées par cryothérapie, RAD ou conisation à froid, selon les cas.



