Home / Training / Manuals / La colposcopia y el tratamiento de la neoplasia intraepitelial cervical: Manual para principiantes / Capítulo 2: Introducción a la neoplasia intraepitelial cervical (NIC)
 Cuadro 2.1 : Correlación entre la ...
Cuadro 2.1 : Correlación entre la ...
 Figura 2.1 : Aspecto citológico de...
Figura 2.1 : Aspecto citológico de...
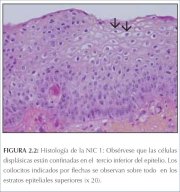 Figura 2.2 : Histología de la NIC ...
Figura 2.2 : Histología de la NIC ...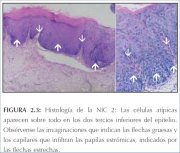 Figura 2.3 : Histología de la NIC ...
Figura 2.3 : Histología de la NIC ...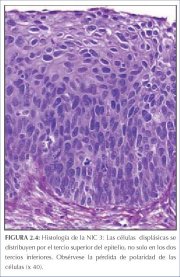 Figura 2.4 : Histología de la NIC ...
Figura 2.4 : Histología de la NIC ...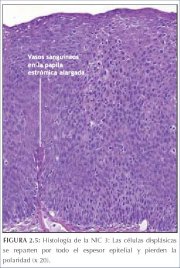 Figura 2.5 : Histología de la NIC ...
Figura 2.5 : Histología de la NIC ...
 Cuadro 2.3 : Probabilidad de regre...
Cuadro 2.3 : Probabilidad de regre... Cuadro 2.4 : Evolución natural de ...
Cuadro 2.4 : Evolución natural de ...
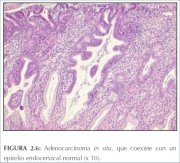 Figura 2.6 : Adenocarcinoma in sit...
Figura 2.6 : Adenocarcinoma in sit...
La colposcopia y el tratamiento de la neoplasia intraepitelial cervical: Manual para principiantes, J.W. Sellors & R. Sankaranarayanan
Capítulo 2: Introducción a la neoplasia intraepitelial cervical (NIC)
Filter by language: English / Français / Español / Portugues / 中文- Los cánceres cervicouterinos invasores de células escamosas vienen precedidos por una larga fase de enfermedades preinvasoras, denominadas colectivamente neoplasia intraepitelial cervical (NIC).
- La NIC se clasifica en grados 1, 2 y 3 según la proporción del espesor epitelial que presenta células maduras y diferenciadas.
- En los grados más avanzados de NIC (2 y 3), la proporción del espesor epitelial con células indiferenciadas es mayor.
- La infección persistente por uno o más de los subtipos oncógenos de papilomavirus humanos (VPH) causa irremediablemente neoplasia cervical.
- La mayoría de las anomalías cervicales causadas por la infección por VPH tienen escasa probabilidad de progresar a NIC o a cáncer cervicouterino de alto grado.
- La NIC de más bajo grado vuelve a la normalidad en plazos relativamente cortos o no progresa a formas de alto grado.
- Es mucho más probable que la NIC de alto grado se convierta en cáncer invasor.
- La lesión precursora originada en el epitelio cilíndrico se denomina adenocarcinoma in situ (AIS). El AIS puede asociarse a la NIC entre uno y dos tercios de los casos.
Los cánceres invasores del cuello uterino vienen
precedidos generalmente por una larga fase de
enfermedades preinvasoras. Esto se caracteriza
microscópicamente por una serie de manifestaciones
que van de la atipia celular a diversos grados de
displasia o neoplasia intraepitelial cervical (NIC o CIN,
según sus siglas en inglés) antes de progresar a
carcinoma invasor. Un buen conocimiento de la
etiología, la fisiopatología y la evolución natural de la
NIC proporciona una buena base para la inspección
visual y el diagnóstico colposcópico, y para
comprender los principios del tratamiento de estas
lesiones. En este capítulo se describe la evolución de
los sistemas de clasificación de los precursores del
cáncer de células escamosas cervicales, las bases
citológica e histológica de su diagnóstico y su
evolución natural en cuanto a las tasas de regresión,
persistencia y progresión. También se describen las
lesiones precancerosas del epitelio cilíndrico cervical,
comúnmente denominadas lesiones glandulares.
El concepto de precursores del cáncer cervicouterino se remonta al final del siglo XIX, cuando se reconocieron zonas de cambios epiteliales atípicos no invasores en muestras de tejidos adyacentes a cánceres invasores (William, 1888). El término carcinoma in situ (CIS) se introdujo en 1932 para denotar las lesiones en las cuales las células carcinomatosas indiferenciadas abarcaban todo el espesor del epitelio, sin interrumpir la membrana basal (Broders, 1932). Ulteriormente se comunicó la asociación entre CIS y cáncer invasor del cuello uterino. El término displasia se introdujo a fines de los años cincuenta para designar la atipia epitelial cervical intermedia entre el epitelio normal y el CIS (Reagan et al., 1953). La displasia se categorizó en tres grupos —leve, moderada y pronunciada— según el grado de afectación de la capa epitelial por las células atípicas. Posteriormente, por largos años, las lesiones precancerosas cervicales se notificaron usando las categorías de displasia y CIS, todavía ampliamente empleadas en muchos países en desarrollo.
Clasificar separadamente la displasia y el CIS fue progresivamente considerándose arbitrario, sobre la base de los resultados de algunos estudios de seguimiento de las mujeres con esas lesiones. Se observó que algunos casos de displasia retrocedían, algunos persistían y otros progresaban a CIS. Se observó una correlación directa entre progresión y grado histológico. Estas observaciones condujeron al concepto de un solo proceso mórbido continuo en el que el epitelio normal evoluciona a lesiones epiteliales precursoras y a cáncer invasor. Sobre la base de dichas observaciones, en 1968 se introdujo el término de neoplasia intraepitelial cervical (NIC) para denotar las múltiples posibilidades de atipia celular confinada al epitelio. La NIC se dividió en los grados 1, 2 y 3 (Richart, 1968). NIC 1 correspondía a la displasia leve, NIC 2 a la displasia moderada y NIC 3 a la displasia grave y al CIS. En los años ochenta fueron reconociéndose cada vez más alteraciones anatomopatológicas como la atipia coilocítica o condilomatosa asociada con la infección por virus del papiloma humano (VPH). Los coilocitos son células atípicas con una cavitación o halo perinuclear en el citoplasma, que indica cambios citopáticos debidos a la infección por el VPH. Esto condujo al desarrollo de un sistema histológico simplificado en dos grados. En 1990 se propuso una terminología histopatológica basada en dos grados de la enfermedad: NIC de bajo grado, que comprendía las anomalías compatibles con atipia coilocítica y las lesiones NIC 1, y NIC de alto grado que comprendía NIC 2 y NIC 3. Se consideró que las lesiones de alto grado eran precursoras ciertas del cáncer invasor (Richart, 1990).
En 1988, el Instituto Nacional del Cáncer de los EE.UU. convocó un seminario para proponer un nuevo esquema de presentación de los resultados de la citología cervical (informe del seminario del Instituto Nacional del Cáncer, 1989; Solomon, 1989; Kurman et al., 1991). Las recomendaciones hechas entonces y su revisión en un segundo seminario celebrado en 1991 fueron denominadas Sistema Bethesda (TBS) (informe del taller del Instituto Nacional del Cáncer, 1992). La característica principal del TBS fue la creación del término “lesión intraepitelial escamosa” (LIE), con dos grados: lesiones de bajo grado (L-LIE) y lesiones de alto grado (H-LIE). La clasificación TBS combina los cambios condilomatosos planos (VPH) y la NIC de bajo grado (NIC 1) en L-LIE, mientras el H-LIE abarca los NIC más avanzados, NIC 2 y NIC 3. Se empleó el término lesión para recalcar que los cambios morfológicos en los cuales se basa un diagnóstico no necesariamente significan proceso neoplásico. El TBS fue diseñado para la notificación citológica, pero sirve también para comunicar resultados histopatológicos. Se utiliza sobre todo en América del Norte. En el cuadro 2.1 se presenta la correlación entre la terminología de displasia o carcinoma in situ, los diversos grados de NIC y el Sistema Bethesda. En este manual, al comentar los diversos grados de lesión escamosa precancerosa cervicouterina, emplearemos la terminología NIC.
El TBS se reevaluó y revisó en un seminario celebrado en el 2001 convocado por el Instituto Nacional del Cáncer, de los Estados Unidos, copatrocinado por 44 sociedades profesionales de más de 20 países (Solomon et al., 2002). En el cuadro 2.2 se resumen las categorías del Sistema Bethesda del año 2001.
El concepto de precursores del cáncer cervicouterino se remonta al final del siglo XIX, cuando se reconocieron zonas de cambios epiteliales atípicos no invasores en muestras de tejidos adyacentes a cánceres invasores (William, 1888). El término carcinoma in situ (CIS) se introdujo en 1932 para denotar las lesiones en las cuales las células carcinomatosas indiferenciadas abarcaban todo el espesor del epitelio, sin interrumpir la membrana basal (Broders, 1932). Ulteriormente se comunicó la asociación entre CIS y cáncer invasor del cuello uterino. El término displasia se introdujo a fines de los años cincuenta para designar la atipia epitelial cervical intermedia entre el epitelio normal y el CIS (Reagan et al., 1953). La displasia se categorizó en tres grupos —leve, moderada y pronunciada— según el grado de afectación de la capa epitelial por las células atípicas. Posteriormente, por largos años, las lesiones precancerosas cervicales se notificaron usando las categorías de displasia y CIS, todavía ampliamente empleadas en muchos países en desarrollo.
Clasificar separadamente la displasia y el CIS fue progresivamente considerándose arbitrario, sobre la base de los resultados de algunos estudios de seguimiento de las mujeres con esas lesiones. Se observó que algunos casos de displasia retrocedían, algunos persistían y otros progresaban a CIS. Se observó una correlación directa entre progresión y grado histológico. Estas observaciones condujeron al concepto de un solo proceso mórbido continuo en el que el epitelio normal evoluciona a lesiones epiteliales precursoras y a cáncer invasor. Sobre la base de dichas observaciones, en 1968 se introdujo el término de neoplasia intraepitelial cervical (NIC) para denotar las múltiples posibilidades de atipia celular confinada al epitelio. La NIC se dividió en los grados 1, 2 y 3 (Richart, 1968). NIC 1 correspondía a la displasia leve, NIC 2 a la displasia moderada y NIC 3 a la displasia grave y al CIS. En los años ochenta fueron reconociéndose cada vez más alteraciones anatomopatológicas como la atipia coilocítica o condilomatosa asociada con la infección por virus del papiloma humano (VPH). Los coilocitos son células atípicas con una cavitación o halo perinuclear en el citoplasma, que indica cambios citopáticos debidos a la infección por el VPH. Esto condujo al desarrollo de un sistema histológico simplificado en dos grados. En 1990 se propuso una terminología histopatológica basada en dos grados de la enfermedad: NIC de bajo grado, que comprendía las anomalías compatibles con atipia coilocítica y las lesiones NIC 1, y NIC de alto grado que comprendía NIC 2 y NIC 3. Se consideró que las lesiones de alto grado eran precursoras ciertas del cáncer invasor (Richart, 1990).
En 1988, el Instituto Nacional del Cáncer de los EE.UU. convocó un seminario para proponer un nuevo esquema de presentación de los resultados de la citología cervical (informe del seminario del Instituto Nacional del Cáncer, 1989; Solomon, 1989; Kurman et al., 1991). Las recomendaciones hechas entonces y su revisión en un segundo seminario celebrado en 1991 fueron denominadas Sistema Bethesda (TBS) (informe del taller del Instituto Nacional del Cáncer, 1992). La característica principal del TBS fue la creación del término “lesión intraepitelial escamosa” (LIE), con dos grados: lesiones de bajo grado (L-LIE) y lesiones de alto grado (H-LIE). La clasificación TBS combina los cambios condilomatosos planos (VPH) y la NIC de bajo grado (NIC 1) en L-LIE, mientras el H-LIE abarca los NIC más avanzados, NIC 2 y NIC 3. Se empleó el término lesión para recalcar que los cambios morfológicos en los cuales se basa un diagnóstico no necesariamente significan proceso neoplásico. El TBS fue diseñado para la notificación citológica, pero sirve también para comunicar resultados histopatológicos. Se utiliza sobre todo en América del Norte. En el cuadro 2.1 se presenta la correlación entre la terminología de displasia o carcinoma in situ, los diversos grados de NIC y el Sistema Bethesda. En este manual, al comentar los diversos grados de lesión escamosa precancerosa cervicouterina, emplearemos la terminología NIC.
El TBS se reevaluó y revisó en un seminario celebrado en el 2001 convocado por el Instituto Nacional del Cáncer, de los Estados Unidos, copatrocinado por 44 sociedades profesionales de más de 20 países (Solomon et al., 2002). En el cuadro 2.2 se resumen las categorías del Sistema Bethesda del año 2001.
 Cuadro 2.1 : Correlación entre la ...
Cuadro 2.1 : Correlación entre la ...Características clínicas de la NIC
No existen síntomas específicos ni características
clínicas que indiquen la presencia de NIC. Sin embargo,
muchas de estas lesiones pueden aparecer blancas tras
aplicar ácido acético al 3-5% y ser yodonegativas
después de aplicar Lugol, pues el epitelio de la NIC
contiene escaso o ningún glucógeno.
Diagnóstico y clasificación de la NIC por la citología
La NIC puede detectarse por examen microscópico de
las células cervicales en un frotis teñido por la técnica
de Papanicolaou. En estas preparaciones citológicas, se
evalúan los cambios de cada célula para el diagnóstico
y la clasificación de NIC. En cambio, el examen
histológico de los tejidos permite examinar otras
características. Evaluar citológicamente la NIC
basándose en los cambios nucleares y citoplasmáticos
suele ser muy difícil (figura 2.1).
La hipertrofia nuclear y los cambios de tamaño y forma son características constantes de todas las células displásicas (figura 2.1). La mayor intensidad tintorial (hipercromasia) es otra característica destacada. Las células displásicas siempre presentan distribución irregular de la cromatina, como en grumos. Los núcleos anormales en las células superficiales o intermedias indican una NIC de bajo grado (las figuras mitóticas y los nucléolos visibles son poco comunes en estos frotis), mientras que la anomalía de los núcleos de células parabasales y basales indica NIC de alto grado. El tamaño del núcleo respecto de la cantidad relativa de citoplasma (relación núcleo/citoplasma) es una de las bases más importantes para evaluar el grado de NIC (figura 2.1). Las mayores relaciones se asocian con grados más avanzados de NIC. En general, en un frotis cervical se observan células con diversos grados de alteración, lo que conlleva bastantes dificultades y una buena dosis de subjetividad al presentar los resultados. La experiencia del citólogo es sumamente importante en el informe final.
La hipertrofia nuclear y los cambios de tamaño y forma son características constantes de todas las células displásicas (figura 2.1). La mayor intensidad tintorial (hipercromasia) es otra característica destacada. Las células displásicas siempre presentan distribución irregular de la cromatina, como en grumos. Los núcleos anormales en las células superficiales o intermedias indican una NIC de bajo grado (las figuras mitóticas y los nucléolos visibles son poco comunes en estos frotis), mientras que la anomalía de los núcleos de células parabasales y basales indica NIC de alto grado. El tamaño del núcleo respecto de la cantidad relativa de citoplasma (relación núcleo/citoplasma) es una de las bases más importantes para evaluar el grado de NIC (figura 2.1). Las mayores relaciones se asocian con grados más avanzados de NIC. En general, en un frotis cervical se observan células con diversos grados de alteración, lo que conlleva bastantes dificultades y una buena dosis de subjetividad al presentar los resultados. La experiencia del citólogo es sumamente importante en el informe final.
 Figura 2.1 : Aspecto citológico de...
Figura 2.1 : Aspecto citológico de...Diagnóstico y clasificación de la NIC por la histopatología
Puede sospecharse NIC por examen citológico con la
técnica de Papanicolaou o mediante examen
colposcópico. El diagnóstico final de NIC se establece
por examen histopatológico de una biopsia cervical con
sacabocados o una muestra de escisión. Se valora si una
muestra tisular cervical presenta NIC y en qué grado, en
función de las características histológicas de
diferenciación, maduración y estratificación de las
células y de las anomalías de los núcleos. Para clasificar
la NIC se observa la proporción del espesor epitelial que
presenta células maduras y diferenciadas. Los grados
más avanzados de NIC suelen tener una mayor
proporción del espesor epitelial con células
indiferenciadas y solo una delgada capa superficial de
células maduras, diferenciadas.
Al realizar el diagnóstico se evalúan anomalías nucleares como la dilatación, la mayor relación núcleo/citoplasma, la hipercromasia, el polimorfismo y la variación del tamaño nuclear (anisocariosis). A menudo existe una fuerte correlación entre la proporción del epitelio que presenta maduración y el grado de anomalía nuclear. Las figuras mitóticas de las células en división son poco frecuentes en el epitelio normal y, cuando existen, se ven solo en la capa parabasal. Conforme se incrementa la gravedad de la NIC aumenta el número de figuras mitóticas, que pueden verse en las capas epiteliales superficiales. Cuanto menos diferenciado es un epitelio, más alto es el nivel en que pueden verse figuras mitóticas. Las configuraciones anormales de las figuras mitóticas también se tienen en cuenta al establecer el diagnóstico final.
En la NIC 1 existe buena maduración, con mínimas anomalías nucleares y pocas figuras mitóticas (figura 2.2). Las células indiferenciadas se encuentran en las capas epiteliales más profundas (tercio inferior). Se observan figuras mitóticas, pero no muchas. Pueden verse cambios citopáticos debidos a la infección por el VPH en todo el espesor del epitelio.
La NIC 2 se caracteriza por cambios celulares displásicos restringidos sobre todo a la mitad o los dos tercios inferiores del epitelio, con anomalías nucleares más marcadas que en la NIC 1 (figura 2.3). Pueden verse figuras mitóticas en toda la mitad inferior del epitelio.
En la NIC 3, la diferenciación y la estratificación pueden faltar por completo o existir solo en el cuarto superficial del epitelio, con abundantes figuras mitóticas (figuras 2.4 y 2.5). Las anomalías nucleares aparecen en todo el espesor del epitelio. Muchas figuras mitóticas tienen formas anormales.
Una estrecha relación entre citólogos, histopatólogos y colposcopistas mejora la notificación en las tres disciplinas. En particular, ayuda a diferenciar los grados más leves de NIC de otras afecciones con las que pueden confundirse.
Al realizar el diagnóstico se evalúan anomalías nucleares como la dilatación, la mayor relación núcleo/citoplasma, la hipercromasia, el polimorfismo y la variación del tamaño nuclear (anisocariosis). A menudo existe una fuerte correlación entre la proporción del epitelio que presenta maduración y el grado de anomalía nuclear. Las figuras mitóticas de las células en división son poco frecuentes en el epitelio normal y, cuando existen, se ven solo en la capa parabasal. Conforme se incrementa la gravedad de la NIC aumenta el número de figuras mitóticas, que pueden verse en las capas epiteliales superficiales. Cuanto menos diferenciado es un epitelio, más alto es el nivel en que pueden verse figuras mitóticas. Las configuraciones anormales de las figuras mitóticas también se tienen en cuenta al establecer el diagnóstico final.
En la NIC 1 existe buena maduración, con mínimas anomalías nucleares y pocas figuras mitóticas (figura 2.2). Las células indiferenciadas se encuentran en las capas epiteliales más profundas (tercio inferior). Se observan figuras mitóticas, pero no muchas. Pueden verse cambios citopáticos debidos a la infección por el VPH en todo el espesor del epitelio.
La NIC 2 se caracteriza por cambios celulares displásicos restringidos sobre todo a la mitad o los dos tercios inferiores del epitelio, con anomalías nucleares más marcadas que en la NIC 1 (figura 2.3). Pueden verse figuras mitóticas en toda la mitad inferior del epitelio.
En la NIC 3, la diferenciación y la estratificación pueden faltar por completo o existir solo en el cuarto superficial del epitelio, con abundantes figuras mitóticas (figuras 2.4 y 2.5). Las anomalías nucleares aparecen en todo el espesor del epitelio. Muchas figuras mitóticas tienen formas anormales.
Una estrecha relación entre citólogos, histopatólogos y colposcopistas mejora la notificación en las tres disciplinas. En particular, ayuda a diferenciar los grados más leves de NIC de otras afecciones con las que pueden confundirse.
 Figura 2.2 : Histología de la NIC ...
Figura 2.2 : Histología de la NIC ... Figura 2.3 : Histología de la NIC ...
Figura 2.3 : Histología de la NIC ... Figura 2.4 : Histología de la NIC ...
Figura 2.4 : Histología de la NIC ... Figura 2.5 : Histología de la NIC ...
Figura 2.5 : Histología de la NIC ...Etiopatogenia de la neoplasia cervical
Algunos estudios epidemiológicos han identificado
varios factores de riesgo que contribuyen a la aparición
de precursores del cáncer cervicouterino y del propio
cáncer. Entre dichos factores figuran la infección con
ciertos tipos oncógenos de papilomavirus humanos
(VPH), las relaciones sexuales a una edad temprana, la
multiplicidad de compañeros sexuales, la multiparidad,
el uso prolongado de anticonceptivos orales, el consumo
de tabaco, la pobreza, la infección por Chlamydia
trachomatis, la carencia de micronutrientes y un
régimen alimentario con pocas frutas y verduras (CIIC,
1995; Bosch et al., 1995; Schiffman et al., 1996;
Walboomers et al., 1999; Franco et al., 1999; Ferenczy
y Franco, 2002).
Los tipos 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 y 68 de VPH están fuertemente asociados con NIC y con cáncer invasor (CIIC, 1995; Walboomers et al., 1999). Se considera que la infección persistente con uno o más de dicho tipos oncógenos causa irremediablemente neoplasia cervical (CIIC, 1995). El análisis de los resultados combinados de un estudio de casos y testigos multicéntrico realizado por el Centro Internacional de Investigaciones sobre el Cáncer (CIIC, 1995) arrojó riesgos relativos (RR) que iban de 17 en Colombia a 156 en Filipinas, con un RR combinado de 60 (intervalo de confianza del 95%: 49-73) de cáncer cervicouterino (Walboomers et al., 1999). La asociación fue similar para el carcinoma escamocelular (RR: 62) y para el adenocarcinoma del cuello uterino (RR: 51). Se detectó ADN del VPH en 99,7% de 1.000 muestras evaluables de biopsia de cáncer cervicouterino obtenidas en 22 países (Walboomers et al., 1999; Franco et al., 1999). El 16 y el 18 son los principales genotipos víricos de VPH encontrados en los cánceres cervicouterinos de todo el mundo.
Varios estudios de cohorte (de seguimiento) comunican una fuerte asociación entre la infección persistente por VPH oncógenos y el riesgo elevado de NIC (Koutsky et al., 1992; Ho et al., 1995; Ho et al., 1998; Moscicki et al., 1998; Liaw et al., 1999; Wallin et al., 1999; Moscicki et al., 2001; Woodman et al., 2001; Schlecht et al., 2002).
La infección por VPH se transmite por contacto sexual, por lo que los factores de riesgo están estrechamente relacionados con el comportamiento sexual (por ejemplo, número de compañeros sexuales o relaciones sexuales a una edad temprana). En la mayoría de las mujeres, las infecciones por VPH son transitorias. La evolución natural de la infección por VPH se ha estudiado mucho. La prevalencia de la infección por VPH varía entre las diferentes regiones del mundo, suele alcanzar un máximo de 20 a 30% de las mujeres de entre 20 y 24 años de edad, y disminuye luego a 3-10% de las mayores de 30 (Herrero et al., 1997a; Herrero et al., 1997b; Sellors et al., 2000). Cerca del 80% de las mujeres jóvenes que contraen VPH presentan infecciones transitorias que se resuelven en el espacio de 12 a 18 meses (Ho et al., 1998; Franco et al., 1999; Thomas et al., 2000; Liaw et al., 2001).
Se cree que la infección por VPH comienza en las células basales o parabasales del epitelio metaplásico. Si la infección persiste, puede suceder que el genoma vírico se incorpore al de la célula anfitriona. La diferenciación normal y la evolución de epitelio escamoso metaplásico inmaduro a maduro puede interrumpirse como resultado de la expresión de oncoproteínas E6/E7 y de la pérdida del control del crecimiento normal. Esto puede conducir ulteriormente a la aparición de epitelio displásico anormal. Si el proceso neoplásico no se interrumpe, las lesiones tempranas de bajo grado pueden llegar a abarcar todo el espesor del epitelio. Después, la enfermedad puede atravesar la membrana basal y convertirse en cáncer invasor, extendiéndose a los tejidos y órganos circundantes. La invasión puede luego alcanzar la sangre y los vasos linfáticos, con lo cual la enfermedad puede diseminarse a los ganglios linfáticos y a órganos distantes.
Los tipos 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 y 68 de VPH están fuertemente asociados con NIC y con cáncer invasor (CIIC, 1995; Walboomers et al., 1999). Se considera que la infección persistente con uno o más de dicho tipos oncógenos causa irremediablemente neoplasia cervical (CIIC, 1995). El análisis de los resultados combinados de un estudio de casos y testigos multicéntrico realizado por el Centro Internacional de Investigaciones sobre el Cáncer (CIIC, 1995) arrojó riesgos relativos (RR) que iban de 17 en Colombia a 156 en Filipinas, con un RR combinado de 60 (intervalo de confianza del 95%: 49-73) de cáncer cervicouterino (Walboomers et al., 1999). La asociación fue similar para el carcinoma escamocelular (RR: 62) y para el adenocarcinoma del cuello uterino (RR: 51). Se detectó ADN del VPH en 99,7% de 1.000 muestras evaluables de biopsia de cáncer cervicouterino obtenidas en 22 países (Walboomers et al., 1999; Franco et al., 1999). El 16 y el 18 son los principales genotipos víricos de VPH encontrados en los cánceres cervicouterinos de todo el mundo.
Varios estudios de cohorte (de seguimiento) comunican una fuerte asociación entre la infección persistente por VPH oncógenos y el riesgo elevado de NIC (Koutsky et al., 1992; Ho et al., 1995; Ho et al., 1998; Moscicki et al., 1998; Liaw et al., 1999; Wallin et al., 1999; Moscicki et al., 2001; Woodman et al., 2001; Schlecht et al., 2002).
La infección por VPH se transmite por contacto sexual, por lo que los factores de riesgo están estrechamente relacionados con el comportamiento sexual (por ejemplo, número de compañeros sexuales o relaciones sexuales a una edad temprana). En la mayoría de las mujeres, las infecciones por VPH son transitorias. La evolución natural de la infección por VPH se ha estudiado mucho. La prevalencia de la infección por VPH varía entre las diferentes regiones del mundo, suele alcanzar un máximo de 20 a 30% de las mujeres de entre 20 y 24 años de edad, y disminuye luego a 3-10% de las mayores de 30 (Herrero et al., 1997a; Herrero et al., 1997b; Sellors et al., 2000). Cerca del 80% de las mujeres jóvenes que contraen VPH presentan infecciones transitorias que se resuelven en el espacio de 12 a 18 meses (Ho et al., 1998; Franco et al., 1999; Thomas et al., 2000; Liaw et al., 2001).
Se cree que la infección por VPH comienza en las células basales o parabasales del epitelio metaplásico. Si la infección persiste, puede suceder que el genoma vírico se incorpore al de la célula anfitriona. La diferenciación normal y la evolución de epitelio escamoso metaplásico inmaduro a maduro puede interrumpirse como resultado de la expresión de oncoproteínas E6/E7 y de la pérdida del control del crecimiento normal. Esto puede conducir ulteriormente a la aparición de epitelio displásico anormal. Si el proceso neoplásico no se interrumpe, las lesiones tempranas de bajo grado pueden llegar a abarcar todo el espesor del epitelio. Después, la enfermedad puede atravesar la membrana basal y convertirse en cáncer invasor, extendiéndose a los tejidos y órganos circundantes. La invasión puede luego alcanzar la sangre y los vasos linfáticos, con lo cual la enfermedad puede diseminarse a los ganglios linfáticos y a órganos distantes.
Evolución natural de los precursores del cáncer cervicouterino
A pesar de la exposición frecuente de las mujeres a los
VPH, la aparición de neoplasia cervical es poco común.
La mayoría de las anomalías cervicales causadas por la
infección por VPH tienen poca probabilidad de progresar
a NIC o a cáncer cervicouterino de alto grado, pues la
mayoría retroceden por sí mismas. El largo plazo que
transcurre entre la infección inicial y la enfermedad
evidente indica que pueden ser necesarios varios
cofactores (diferencias genéticas, efectos hormonales,
carencias de micronutrientes, tabaquismo o inflamación
crónica) para que avance la enfermedad. La regresión
espontánea de la NIC también parece indicar que
muchas mujeres pueden no estar expuestas a dichos
cofactores.
Varios estudios han abordado la evolución natural de la NIC, haciendo hincapié en la regresión, la persistencia y la progresión de la enfermedad (McIndoe et al., 1984; Ostor et al., 1993; Mitchell et al., 1994; Melinkow et al., 1998; Holowaty et al., 1999). Han revelado que la mayoría de las lesiones de bajo grado son transitorias; que en la mayoría de los casos vuelven a la normalidad en plazos relativamente cortos o no progresan a formas más graves. En cambio, es mucho más probable que la NIC de alto grado se convierta en cáncer invasor, aunque también algunas de estas lesiones persisten como tales o retroceden. El intervalo medio para que los precursores progresen a cáncer invasor va de 10 a 20 años.
Algunos estudios han intentado resumir las tasas de regresión, persistencia y progresión de la NIC. Aunque estos estudios tengan muchas limitaciones, proporcionan ciertas pistas sobre el comportamiento biológico de tales lesiones. En el cuadro 2.3 se presenta el análisis de los resultados combinados de los estudios publicados de 1950 a 1993 (Ostor et al., 1993). En otro resumen, la probabilidad acumulada para todos los grados de NIC estudiados tanto por citología como por histología es de 45% de regresión, 31% de persistencia y 23% de progresión (Mitchell et al., 1994). Las tasas de progresión a cáncer invasor en estudios de seguimiento por biopsia de pacientes con carcinoma in situ se situaban entre 29% y 36% (McIndoe et al., 1984). Un metanálisis de 27.000 mujeres dio las tasas ponderadas de progresión a H-LIE y a cáncer invasor a los 24 meses, según la anomalía citológica de referencia, que se presentan en el cuadro 2.4 (Melinkow et al., 1998). Holowaty et al. (1999) calcularon el RR de progresión y de regresión de displasias moderadas y avanzadas en un seguimiento de 2 años, tomando como referencia la displasia leve. El RR de CIS fue 8,1 para la displasia moderada y 22,7 para la displasia grave. El correspondiente RR de cáncer invasor fue 4,5 y 20,7 respectivamente.
Varios estudios han abordado la evolución natural de la NIC, haciendo hincapié en la regresión, la persistencia y la progresión de la enfermedad (McIndoe et al., 1984; Ostor et al., 1993; Mitchell et al., 1994; Melinkow et al., 1998; Holowaty et al., 1999). Han revelado que la mayoría de las lesiones de bajo grado son transitorias; que en la mayoría de los casos vuelven a la normalidad en plazos relativamente cortos o no progresan a formas más graves. En cambio, es mucho más probable que la NIC de alto grado se convierta en cáncer invasor, aunque también algunas de estas lesiones persisten como tales o retroceden. El intervalo medio para que los precursores progresen a cáncer invasor va de 10 a 20 años.
Algunos estudios han intentado resumir las tasas de regresión, persistencia y progresión de la NIC. Aunque estos estudios tengan muchas limitaciones, proporcionan ciertas pistas sobre el comportamiento biológico de tales lesiones. En el cuadro 2.3 se presenta el análisis de los resultados combinados de los estudios publicados de 1950 a 1993 (Ostor et al., 1993). En otro resumen, la probabilidad acumulada para todos los grados de NIC estudiados tanto por citología como por histología es de 45% de regresión, 31% de persistencia y 23% de progresión (Mitchell et al., 1994). Las tasas de progresión a cáncer invasor en estudios de seguimiento por biopsia de pacientes con carcinoma in situ se situaban entre 29% y 36% (McIndoe et al., 1984). Un metanálisis de 27.000 mujeres dio las tasas ponderadas de progresión a H-LIE y a cáncer invasor a los 24 meses, según la anomalía citológica de referencia, que se presentan en el cuadro 2.4 (Melinkow et al., 1998). Holowaty et al. (1999) calcularon el RR de progresión y de regresión de displasias moderadas y avanzadas en un seguimiento de 2 años, tomando como referencia la displasia leve. El RR de CIS fue 8,1 para la displasia moderada y 22,7 para la displasia grave. El correspondiente RR de cáncer invasor fue 4,5 y 20,7 respectivamente.
 Cuadro 2.3 : Probabilidad de regre...
Cuadro 2.3 : Probabilidad de regre... Cuadro 2.4 : Evolución natural de ...
Cuadro 2.4 : Evolución natural de ...Adenocarcinoma in situ
La lesión precursora, cuya procedencia del epitelio
cilíndrico se conoce, se denomina adenocarcinoma in
situ (AIS). En el AIS, el epitelio cilíndrico normal es
reemplazado por epitelio anormal que presenta pérdida
de la polaridad, células y núcleos de mayor tamaño,
hipercromasia nuclear, actividad mitótica, menor
expresión de la mucina citoplasmática y estratificación
celular o acumulación (figura 2.6). También pueden
observarse ramificaciones glandulares anormales y
glándulas arracimadas con proyecciones epiteliales
papilares intraluminales sin islotes de estroma. Puede
subdividirse, según el tipo de células, en endocervical,
endometrioide, intestinal y mixto. La mayoría de los AIS
se encuentran en la zona de transformación. El AIS
puede asociarse a la NIC de epitelio escamoso entre uno
y dos tercios de los casos.
 Figura 2.6 : Adenocarcinoma in sit...
Figura 2.6 : Adenocarcinoma in sit...



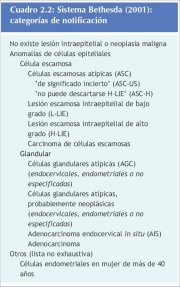 Cuadro 2.2: Sistema Bethesda (2001)
Cuadro 2.2: Sistema Bethesda (2001)